Xinazolon-4 va uning hosilalarini d-metallar bilan oddiy va aralash ligandli koordinasion birikmalari sintezi

![MUNDARIJA
KIRISH .....................................................................................................................3
I BOB. ADABIYOTLAR SHARHI
1.1. Kompleks birikmalar sintezi................. ………….........……………......…7
1.2. Koordinasion birikma hosil qiluvchilar va ligandlar…….............…….....12
1.3. Kompleks birikmalar sinflari....................…………………………........ .19
1.4. Koordinasion birikmalarni nomlanishi ….................……………….........25
1.5. Koordinasion birikmalarni kimyoviy bog’lanish tabiati............................28
1.6. Elektrostatik (Kossel va Magnus) nazariyasi.............................................34
1.7. Kovalent bog’lanish nazariyasi .................................................................35
II BOB. TAJRIBA QISMI
2.1. Xinazolon-4 ni Cu(II) tuzlari bilan kompleks birikmalari sintezi..............47
2.2. Xinazolon-4 va uning 2-tiokso- hamda 2-oksohosilalarini mis(II) tuzlari
bilan aralash ligandli kompleks birikmalari sintezi....................................47
2.3. Xinazolon-4 va uning 2-tiokso-5,7-dimetilpirido[2,3-d] pirimidinon-4
hosilasini mis(II) tuzlari bilan aralash ligandli kompleks birikmalari
sintezi..........................................................................................................48
2.4. Xinazolon-4 va uning 2-aminohosilasini mis(II) tuzlari bilan aralash
ligandli kompleks birikmalari sintezi..........................................................48
III BOB. OLINGAN NATIJALAR VA ULARNING TAHLILI
3.1. Xinazolon-4 va uning kaliyli hamda natriyli tuzlarini sintezlash usullari .50
3.2. Xinazolon-4 ni mis(II) tuzlari bilan 1:1, 1:2 va 1:3 tarkibli kompleks
birikmalari...................................................................................................51
3.3. Cu(Xz)(TXz) .
H
2 O va Cu(Xz)(OXz) .
2H
2 O kompleks birikmalarining IQ-
spektri.........................................................................................................53
3.4. Cu(Xz)(TPP) .
H
2 O kompleks birikmasining IQ-spektri..............................54
3.5. Cu(Xz)(AXz) .
H
2 O kompleks birikmasining IQ-spektri.............................55
XULOSA ................................................................................................................57
FOYDALANILGAN ADABIYOTLAR ..............................................................58
2](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_10.png?v=1)

![Harakatlar strategiyasiga O’zbekiston Respublikasi Prezidenti Shavkat
Mirziyoyevning saylovoldi uchrashuvlarida qayd etilgan mamlakatni har
tomonlama rivojlantirishga oid konseptual g’oyalar metodologik asos bo’ldi [1].
Mazkur Harakatlar strategiyasida quyidagi 5 ta ustuvor yo’nalishlar belgilangan:
1. Davlat va jamiyat qurilishini takomillashtirish.
2. Qonun ustuvorligini ta’minlash va sud-huquq tizimini yanada isloh qilish.
3. Iqtisodiyotni yanada rivojlantirish va liberallashtirish.
4. Ijtimoiy sohani rivojlantirish.
5. Xavfsizlik, millatlararo totuvlik va diniy bag’rikenglikni ta’minlash, chuqur
o’ylangan, o’zaro manfaatli va amaliy ruhdagi tashqi siyosat yuritish.
Harakatlar strategiyasini beshta bosqichda, ya’ni 2017-2021 yillarda amalga
oshirish nazarda tutilmoqda. Bunda yillarga beriladigan nomlarga muvofiq har yili
uni amalga oshirish bo’yicha Davlat dasturi tasdiqlanadi.
2017 yil uchun Davlat dasturi yuqoridagi Prezident Farmoni bilan
tasdiqlandi. Harakatlar strategiyasining «Xalq bilan muloqot va inson manfaatlari
yili»da amalga oshirishga oid Davlat dasturi 320 ta banddan iborat muhim
vazifalarni o’z ichiga olgan.
«Xalq bilan muloqot va inson manfaatlari yili» Davlat dasturida Oliy Majlis
tomonidan 55 ta qonun va 15 ta qarorlar qabul qilinishi, shuningdek O’zbekiston
Respublikasi Prezidentining 8 ta Farmoni, 21 ta Qarori qabul qilinishi, Vazirlar
Mahkamasining 25 ta Qarori loyihasini ishlab chiqish, shuningdek 8 ta konsepsiya,
1 ta milliy dastur va turli dolzarb masalalar yuzasidan 37 ta chora-tadbirlar
dasturlari tayyorlanishi belgilangan.
Mazkur Davlat dasturini amalga oshirish uchun 37,7 trillion so’m va 8,3
milliard AQSH dollari yo’naltirilayotgani ham uning naqadar keng qamrovli
ekanini ko’rsatadi.
Davlat dasturining birinchi, ya’ni «Davlat va jamiyat qurilishini
takomillashtirish» deb nomlangan yo’nalishini amalga oshirishda davlat
hokimiyati tizimida Oliy Majlisning rolini yanada kuchaytirish, qonun ijodkorligi
4](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_12.png?v=1)
![faoliyatining sifatini tubdan yaxshilash, jamiyat hayotida siyosiy partiyalarning
rolini kuchaytirish nazarda tutilgan.
Davlat dasturining ikkinchi yo’nalishi qonun ustuvorligini va sudning
chinakam mustaqilligini ta’minlash deb nomlanib, unda 63 ta banddan iborat
vazifalar belgilangan.
«Iqtisodiyotni yanada rivojlantirish va liberallashtirish» deb nomlangan
uchinchi yo’nalishda ko’rsatilgan chora-tadbirlarni ro’yobga chiqarish uchun
milliy valyuta va narxlarning barqarorligini ta’minlash, mahalliy budjetlarning
daromad bazasini kengaytirish, eksportga mo’ljallangan mahsulot va materiallar
ishlab chiqarish uchun zamonaviy texnologiyalarni joriy etish, soliq
ma’murchiligini yaxshilash, bank faoliyatini tartibga solishning zamonaviy
mexanizmlarini joriy etish nazarda tutilmoqda. Davlat dasturining uchinchi
yo’nalishida 77 ta vazifa belgilangan.
«Ijtimoiy sohani rivojlantirish» deb nomlangan to’rtinchi yo’nalish aholi
bandligini oshirish, fuqarolarni ijtimoiy himoya qilish va ularning salomatligini
saqlash, yo’l-transport, muhandislik-kommunikatsiya hamda ijtimoiy
infratuzilmani rivojlantirish va modernizatsiyalash, aholini elektr energiya, gaz
bilan ta’minlashni yaxshilash, aholining muhtoj qatlamlariga ko’rsatiladigan
ijtimoiy yordam sifatini oshirish, xotin-qizlarning ijtimoiy-siyosiy hayotdagi
maqomini oshirish, sog’liqni saqlash sohasini isloh qilish, maktabgacha ta’lim
muassasalarining qulayligini ta’minlash, umumiy o’rta ta’lim, o’rta maxsus va oliy
ta’lim sifatini yaxshilash hamda ularni rivojlantirish chora-tadbirlarini amalga
oshirishni nazarda tutadi [2].
Muxtasar aytganda, Harakatlar strategiyasining amalga oshirilishi
O’zbekiston Respublikasining rivojlangan bozor iqtisodiyotiga asoslangan huquqiy
demokratik davlat, kuchli fuqarolik jamiyati barpo etish, qonun ustuvorligini
ta’minlash yo’lidagi harakatlariga yangicha mazmun olib kirmoqda.
Mavzuning dolzarbligi. Yangi yuqori effektli biologik faol preparatlar
yaratish zamonaviy medisinamiz va qishloq xo’jaligimiz uchun muhim
muammolardan biri hisoblanadi. Bu muommolarni hal etish uchun esa, yangidan-
5](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_13.png?v=1)
![yangi fiziologik faol bo’lgan birikmalarni sintez qilish va ularni zamonaviy usullar
yordamida o’rganishdan iboratdir.
Ma’lumki, biologik faol bo’lgan birikmalar tarkibiga biometallarni kiritilishi
ularning nafaqat zararli tomonlarini kamaytiribgina qolmasdan balki, ko’pgina
hollarda biologik faolligini oshoradi yoki yangi biologik xususiyatlarni namoyon
qiladi. Shunung uchun yangi yuqori effektli biopreparatlarni sintezlash va
o’rganish ham nazariy jihatdan, ham amaliy jihatdan qiziqish uyg’otadi.
Bitiruv malakaviy ishining mavzusi ham biologik faol bo’lgan preparatlar
yaratish maqsadida koordinatsion birikmalar sintezlash va ularni zamonaviy
usullar yordamida fizik-kimyoviy xossalarini o’rganishga bag’ishlangan. Bunday
faol moddalarni sintezlash, xalq xo’jaligida qo’llash, qishloq xo’jaligi va
medisinamizni dorivor preparatlar bilan taminlash hozirgi kunda dolzarb
muammolardan biri hisoblanadi.
Bitiruv malakaviy ishining maqsadi va vazifalari. Xinazolon-4 va uning
hosilalari tarkibida donor atomlarning (N, S, O) bo’lish, ularni har xil
toutomeriyalarga uchrashi; va shu atomlar hisobiga metallar bilan har xil
koordinatsiyaga uchrashi ham nazariy, ham amaliy jihatdan qiziqish uyg’otadi.
Bitiruv malakaviy ishining maqsadi xinazolon-4 va uning 2-okso-, 2-tiokso-,
2-amino- hamda 2-tiokso-5,7-dimetilpirido[2,3-d] pirimidinon-4 hosilalarini mis
tuzlari aralash ligandli kompleks birikmalarini sintezlash; vazifasi esa , qaysi donor
atomlar markaziy ion bilan koordinatsiyaga uchrashini fizik-kimyoviy usullar
yordamida o’rganishdan iboratdir.
Bitiruv malakaviy ishning ilmiyligi. Bitiruv malakaviy ishining ilmiylik
tomoni shundaki, hozirgi vaqtga qadar olingan adabiyot ma’lumotlariga ko’ra
xinazolon-4 va uning 2-okso-, 2-tiokso-, 2-amino- hamda 2-tiokso-5,7-
dimetilpirido[2,3-d] pirimidinon-4 hosilalarining mis(II) tuzlari bilan aralash
ligandli kompleks birikmalari sintez qilinmagan. Biologik faol bo’lgan xinazolon-4
va uning hosilalarini biometallar bilan koordinatsion birikmalarini sintezlash
hamda turli xil fizik-kimyoviy xossalarini zamonaviy usullar (element analizi, IQ-,
EPR-, UB-spektroskopiya) bilan o’rganish ilmiy jihatdan katta ahamiyatga egadir.
6](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_14.png?v=1)
![I BOB. ADABIYOTLAR SHARHI
1.1. Koordinatsion birikmalar sintezi
Koordinatsion birikmalar olishda quyidagi sintez usullaridan foydalaniladi:
1) muvozanatli va 2) genealogik sintezlar.
Muvozanatli sintezda asosiy rolni termodinamik munosabatlar bajaradi.
Bunda ”mahsulotlar” energitik manfaat jihatidan dastlabki moddalardan ko’ra
afzalroq bo’lishi kerak. Bunda reaksiyalarning mexanizmi ikkinchi darajali
hisoblanadi, ba’zan ”mahsulotlarning” tuzilishi dastlabki moddalarning
tuzilishidan umuman boshqacha bo’lishi mumkin [3].
Muvozanatli sintezni olib borish uchun quyidagi shartlarga rioya qilish kerak:
1. Koordinatsion birikma hosil bo’lish jarayonini ta’minlash uchun zaruriy harorat
va boshqa sharoitlar tanlash;
2. Muvozanatni mahsulotlar hosil bo’lish tomoniga qarata siljitish choralarini
izlash;
3. Zaruriyat bo’lsa, dastlabki moddalar energiyasini imkoni boricha oshirish;
4. Agar koordinatsion birikma hosil qilish jarayoni mahsulotni saqlash mumkin
bo’lmagan sharoitda amalga oshirilgan bo’lsa, ”muvozanatni yaxlatish” usuli
tanlanadi.
Genealogik sintezda mahsulotning tuzilishi dastlabki moddalar kattaroq
energiyaga ega bo’lishiga, harorat tanlashga, yaroqli katalizator ishlatishga,
reaksiya mahsulotini saqlab qolish sharoitini tanlashga etibor beriladi. Ikkala
usulda ham mahsulotni tozalash, uni ajratib olish, kimyoviy analiz qilish kabi
ishlarni to’liq bajarish talab qilinadi. Sintez ishining barcha bosqichlarini taftish
etib borishda fizik-kimyoviy izlanish usullari, qisqa to’qinli spektroskopiya, yadro
magnet rezonans (YaMR)-spektroskopiya usullari katta yordam beradi.
Muvozanatli sintezda Gibbs energiyasining o’zgarishi ∆G=-RTlnK
M +
RT∑n
i lnC
i manfiy qiymatga ega bo’lishi kerak. Bu yerda K
M -reaksiyaning
muvozanat doimiysi, n
i -stexiometrik koeffitsientlar; C
i -i moddaning
konsentratsiyasi Le-Shatele qoidasiga muvofiq, temperatura ko’tarilganda
7](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_15.png?v=1)
![endotermek reaksiya mahsulotlarining unumi ortadi; bosim oshirilganda hajm
kamayadigan tomonga yo’nalgan reaksiya mahsulotlari unumi ortadi; dastlabki
moddalar konsentratsiyasi oshirilganda koordinatsion birikmalarning hosil bo’lishi
kuchayadi. Yana shuni aytib o’tishimiz kerakki, bunday koordinatsion birikmalar
hosil qilishda berilgan moddalarning bir-birida eruvchanligini tekshirish
natijalaridan va moddalar sistemasining holat diagrammasidan keng foydalaniladi.
Bunday diagrammalarga asoslanib, koordinatsion birikmaning hosil bo’lishidagi
konsentratsiyalar sohasi aniqlanadi. Masalan, ZnCl
2 -glitsin (NH
2 CH
2 COOH) va
suvdan iborat sistemaning 50 0
dagi eruvchanlik diagrammasiga asoslanib, bu
sistemada uchta birikma: ZnCl
2 .
NH
2 CH
2 COOH, ZnCl
2 .
2NH
2 CH
2 COOH va
ZnCl
2 .
3NH
2 CH
2 COOH hosil bo’lishi aniqlangan [4], [5].
Koordinatsion birikmalar hosil qilishni ma’lum temperatura sharoitida amalga
oshirishda ko’pincha termogravimetrik tekshirishi (ya’ni sestemadan yengil
uchuvchan ligand chiqib ketishi tufayli modda massasining vaqt va temperatura
ortishi bilan kamayishini aniqlash) natijalaridan ham foydalaniladi.
Kompleks birikmalar hosil bo’ladigan jarayonlarning mohiyatini tushunib olish
uchun, biz 1894-yilda Shvetsiya mamlakatining kimyogar olimi A.Verner taklif
qilgan va L.A.Chugayev, I.L.Cherniyayev, A.A.Grinberg va boshqa olimlar
tomonidan to’ldirilgan koordinatsion nazariya bilan tanishib o’tamiz [11], [6].
Bu nazariyaning asosiy bandlari quyidagilardan iborat:
1. Kompleks birikmalardagi ion yoki atomlardan biri, markaziy ion hisoblanadi va
uni kompleks hosil qiluvchi deb ataladi.
2. Kompleks hosil qiluvchi markaziy ion atrofiga ma’lum iondagi, qarama-qarshi
zaryadli ionlar yoki polimolekulalar, ya’ni ligandlar joylanadi, boshqacha
aytganda ular koordinatsiyalanadi.
3. Markaziy ion yoki atom legandlar bilan kompleks birikmaning ichki sferasini
hosil qiladi, ichki sfera kvadrat qavslar ichiga yoziladi.
4. Ko’pgina markaziy ion yoki atom bilan bevosita birikkan ligandlar soni, ya’ni
markaziy atomning koordinatsion soni 2, 4, 6, 8 ga teng qiymatlarga ega
bo’ladi.
8](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_16.png?v=1)
![5. Ko’pchilik elementlar o’zlarining asosiy valentliklaridan tashqari, yana
qo’shimcha valentliklar namoyon qiladi.
6. Har qaysi element o’zining asosiy va qo’shimcha valentliklarni tuyintirishga
intiladi.
7. Markaziy atomning qo’shimcha valentliklari fazoda ma’lum yunalishiga ega
bo’ladi.
A.Verner nazariyasi koordinatsion nazariya bo’lib hisoblanadi. A.Vernerning
fikricha birinchi tartibdagi birikmalar asosiy valentlik hisobiga hosil bo’ladi,
kompleks birikmalar esa, qo’shimcha valentlik hisobiga hosil bo’ladi. Masalan:
PtCl
4 bilan KCl birikib, PtCl
4 .
2KCl ni hosil qiladigan Pt va Cl atomlari o’zlarining
asosiy valentliklaridan tashqari yana qo’shimcha valentliklarni namoyon qiladi:
Bu yerda yoppa chiziqlar asosiy valentlikni, strepka bilan ko’rsatilgan
chiziqlar esa, qo’shimcha valentlikni ya’ni koordinatsion bog’ni namoyon qiladi.
Hozirgi zamon termini bilan aytganda asosiy valentlik elementining ayni
birikadigan oksidlanish darajasini qo’shimcha valentlik esa, uning koordinatsion
sonini ko’rsatadi. PtCl
4 .
2KCl da platinaning asosiy valentligi 4 ga, qo’shimcha
valentligi esa 6 ga tengdir.
Kompleks birikma tarkibidagi markaziy atom bilan legandlar orasidagi
bog’lanishlar soni markaziy atomning koordinatsion soni deb ataladi. Kompleks
birikmalarda markaziy atom bilan ligandlar orasidagi bog’lanishlar soni bir xil
kuchga ega bo’ladi [7].
Koordinatsion nazariya asosida tarkibida ammiak ioni bo’lgan moddalarni
(NH
4 Cl), tuzlarning kristal gidratlari (CuSO
4 .
5H
2 O) ni ko’zdan kechirib chiqsak,
bunday moddalar kompleks birikmalar jumlasiga kiradi.
[NH
4 ] Cl, [Cu (H
2 O)
4 ] SO
4 .
H
2 O, [Cu(NH
3 )
4 ]Cl
2
9](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_17.png?v=1)
![Kompleks birikmalarda markaziy ion yoki atom bilan ligantlar orasidagi
kimyoviy bog’lanish tabiati ikki xil bo’lishi mumkin:
1. Ligantlar kompleks hosil qiluvchiga nisbatan qarama-qarshi zaryadli
zarrachalar bo’lganligi sababli, kompleks birikmalarda bir tomondan markaziy ion
bilan ligantlar orasida elektrositatik tortishuv kuchlari orqali bog’lanish amalga
oshishi mumkin.
2. Ligandlar sifatida qutbli molekulalar odatda ko’pincha suv va ammiak
molekulalari ham bo’lishi mumkin. Masalan: mis (II) sulfatining kristall gidratida
suv molekulalari o’zlarining manfiy qutblari orqali musbat zaryadlangan mis (II)
ioniga tortiladi. Buni sximatik ravishda quyidagicha yozamiz:
Bu kompleks birikmanitetraakvo mis (II) sulfat gidrat deb nomlash mumkin.
Ikkinchi tomondan markaziy atom bilan ligandlar orasida xuddi ammoniy ionidagi
kabi donor akseptor mexanizmiga muvofiq bog’lanish namoyon bo’ladi.
Ko’pchilik kompleks birikmalarda markaziy ion yoki atom bilan ligandlar orasida
ham elektrositatik tortishuv kuchlari, ham donor akseptor mexanizm tufayli
vujudga keladigan bog’lanishlar uchraydi. Bunda kompleks hosil qiluvchining
ajralmas elektron juftlari ligantlar bosh orbitallariga joylashishi hisobiga
bog’lanish amalga oshadiyoki aksincha ko’pchilik kompleks birikmalar
elektronitral bo’ladi. Masalan: Kaliy(2) Geksasianoferrat suvdagi eritmada
quyidagicha dissosialanadi [8]:
K
4 [Fe(CN)
6 ] ↔ 4K +
+ [Fe(CN)
6 ] 4-
Kompleks birikmalar dissosiallanganda kompleks ionlar hosil. Ularning
dissosialanish darajasi juda kichik, ular xiyla mustahkam ionlardir. Koordinatsion
birikmalar tabiatda keng tarqalgan bo’lib, hozirgi kunda ko’pgina metal organik
birikmalar, vitaminlar, qon gemoglabini, xlorofil va boshqalar shunday
birikmalardan hisoblanadi. Kompleks birikmalarda metall atomlarni o’rab turuvchi
10](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_18.png?v=1)
![molekula yoki ionlar ligandlar ya’ni bog’lovchilar ham deb ataladi. Ular eng
kamida bitta bo’linmagan valent elektronlar juftiga ega bo’ladi.
Kompleks birikmadagi markaziy metall atomi bilan to’g’ridan-to’g’ri
bog’langan ligand atomi donor deyiladi. [Pt(NH
3 )
4 ] 2+
- kompleks ionida donor azot
atomi hisoblanadi. Metall ioni bilan bog’langan donor atomlar soni unig
koordinatsion soni deb yuritiladi. Yuqoridagi kompleks birikmadagi platinning
koordinatsion soni 4 ga, [Co(NH
3 )
6 ] 3+
da esa kobaltning koordinatsion soni oltiga
teng. Ba’zi metallar ionlari doimiy koordinatsion songa ega bo’ladi. Uch valentli
xrom bilan kobaltning koordinatsion soni 6 ga, ikki valentli platinaning
koordinatsion soni 4 ga tengligi aniqlangan. Koordinatsion son ko’pincha 4 ga va 6
ga teng bo’ladi. Bu son metall ionining katta-kichikligi va uni o’rab turgan
ligandlar miqdoriga ham bog’liq bo’ladi. Markaziy ionning koordinatsion soni 1
dan 12 gacha bo’lishi mumkin. Lekin 8 dan katta koordinatsion son kam uchraydi.
Bir valentli elementlarning koordinatsion soni ko’pincha 2 ga teng bo’ladi.
Masalan:
[Ag (NH
3 )
2 ]Cl; K[Ag(CN)
2 ]
Ikki valentli elementlarning koordinatsion soni ko’pincha 4 ga ba’zan esa, 3
ga va 6 ga teng bo’ladi. Masalan: Na[PbJ
3 ]; K
4 [Fe(CN)
6 ]; [Zn(NH
3 )
4 ]Cl
2
Uch va to’rt valentli elementlarning koordinatsion sonlari asosan 6 ga teng.
Masalan: K
4 [Fe(CN)
6 ]
Besh valentli elementlarning koordinatsion soni 7 ga teng bo’ladi: Masalan:
K
2 [NbF
7 ]
Umuman shuni aytib o’tish kerakki, ayni elementning koordinatsion soni
elementning valentligiga ligandlar eritmasikoisentratsiyasiga va markaziy ion
radiusining ligand radiusiga bo’lgan nisbatiga bog’liq bo’ladi. Magniusining
ko’rsatishiga ko’ra R
m :R
L nisbat 0,155 dan 0,225gacha bo’lsa, markaziy ionning
koordinatsion soni 3 ga teng. 0,225 dan 0,414gacha bo’lsa markaziy ionning
koordinatsion soni 4 ga teng bo’ladi. R
m :R
L nisbat 0,414 dan 0,732 gacha bo’lsa,
markaziy ionning koordinatsion soni 6 ga teng. R
M :R
L nisbati 0,732 dan1,32 gacha
bo’lsa, markaziy ionning koordinatsion soni 8 ga teng bo’ladi [9].
11](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_19.png?v=1)
![Markaziy atom bilan ligandlar kompleks birikma ichki sferasini tashkil qiladi.
Masalan: CoCl
3 .
6NH
3 da oltita ammiak kobalt bilan bevosita birikkan bo’lib, 3 ta
xlor kompleksning tashqi sferasiga joylanadi. Tashqi sferadagi zarrachalar ichki
sfera bilan ionli bog’langan bo’ladi.
Masalan: [Co(NH
3 )
6 ]Cl
3 , [Cu(NH
3 )
4 ]Br
2 , [Co(H
2 O)
6 ] (NO
3 )
2
Suvda eritilsa, u to’rtta ionga parchalanadi:
[Co(NH
3 )
6 ]Cl
3 ↔[Co(NH
3 )
6 ] 3+
+3Cl -
Bu eritmadagi xlorni kumush nitrat eritmasi bilan AgCl holida cho’ktirish
mumkin:
[Co(NH
3 )
6 ] Cl
3 +3AgNO
3 → [Co(NH
3 )
6 ](NO
3 )
3 +3AgCl↓ [Co(NH
3 )
5 Cl]Cl
2
tarkibli kompleks birikmaning ichki sferasida 5 ta ammiak molekulasi va bitta xlor
ioni, tashqi sferada esa, 2 ta xlor ioni bo’ladi [4].
Bu modda eritmada faqat 3ta ionga parchalanadi. Uning eritmasi kumush
nitrat qo’shilganda hamma xlorning 2/3 qismigina AgCl holida cho’kmaga tushadi:
[Co(NH
3 )
5 Cl]Cl
2 +AgNO
3 →[Co(NH
3 )
5 Cl](NO
3 )
2 +2AgCl↓ [Co(NH
3 )
4 Cl
2 ]Cl
tarkibli kompleks birikma esa, faqat ikki + ta ionga parchalanadi:
[Co (NH
3 )
4 Cl
2 ] Cl↔[Co(NH
3 )
4 Cl
2 ] +
+Cl -
Kumush nitrat ta’sir ettirilganda xlorning faqat 1/3 qismi cho’kadi:
[Co(NH
3 )
4 Cl
2 ]Cl+AgNO
3 →[Co(NH
3 )
4 Cl
2 ]NO
3 +AgCl↓
[Co(NH
3 )
3 Cl
3 ]–tarkibli kompleks birikma esa, alohida o’rinni egallaydi. A.Verner
nazariyasiga binoan u suvda eritilganda ionlarga parchalanmaydi. Shuning uchun
ham kam eruvchan neytral kompleks birikma bo’lib, AgNO
3 eritmasi ta’sirida xlor
ionlari, AgCl holida cho’kmaga tushmaydi. Uning elektr o’tkazuvchanligi nolga
yaqin bo’ladi.
1.2. Koordinatsion birikma hosil qiluvchilar va ligandlar
Uzoq vaqtlardan buyon olib borilgan tadqiqotlar natijasida XIX asrning
oxirlariga kelib, barcha kimyoviy birikmalr ikki turkumga bo’linadi. Bularning
birinchisi atom yoki soda birikmalr va ikkinchisi murakkab yoki molekulyar
birikmalar nomini oldi. Keyinroq bir xil birikmalarni birinchi tarkibdagi
12](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_2.png?v=1)
![birikmalar, ikkinchi xillari esa yuqori tarkibdagi birikmalar deb ataldi. CuCl
2 , BF
2 ,
NH
3 , FeCl
3 kabi moddalar birinchi tartibdagi moddalar tarkibiga kiritildi. Ularning
hosil bo’lishi valentlik qoidasiga bo’ysunadi. Yuqori tartibdagi moddalar biror
soda birikmaning boshqa biror soda birikma bilan o’zaro birikishi natijasida hosil
bo’ladi. Masalan: Mis xlorid eritmasining ammiak ta’sir ettirilganda, bu ikki soda
birikmadan molekulyar birikma hosil bo’ladi [4], [10]:
CuCl
2 +4NH
3 →CuCl
2 .
4NH
3
Ba’zi bir murakkab moddalar boshqa murakkab moddalar bilan ximiyaviy
o’zaro ta’sirlashganda yanada murakkabroq moddalar hosil bo’ladi. Bunday
reaksiyalar uchun xarakterli insonlar tuzlarning suv bilan birikish, ionlarning
gidratlanish, ammiakning suvga va kislotalarga birikishi turli tartibdagi
alyuminatlarning hosil bo’lishini keltirish mumkin. Bunday reaksiyalar natijasida
hosil bo’ladigan moddalar kompleks birikmalar jumlasiga kiradi.
Vaqt o’tishi bilan yuqori tartibdagi birikmalarning soni ko’patib bordi.
Keyinchalik yuqori tartibli birikmalar nisbatan barqarorlarini kompleks birikmalar
deb ataladigan bo’ldi.
Koordinasion birikma shunday birikmaki, uning molekulasi yoki ioni
markaziy ion yoki atomga ega bo’lib, buni bir necha ion yoxud molekulalar, ya’ni
ligandlar qurshab turadi.
Akademik Yu. N. Kukushkin kompleks birikmalarga quyidagi ta’rifni berdi:
“Kompleks birikma deganda kristall holatda bo’lmasin, eritmada bolmasin,
tarkibida ligandlar bilan qurshalgan markaziy atomi mavjud birikmalarni
tushunmoq kerak.
Kompleks hosil bo’lish hodisasi ayrim elementlardagina uchramasdan, balki
D. I. Mendeleyev davriy sistemasining ko’pchilik elementlariga xos hodisadir.
Tassir 1798-yilda birinchi bo’lib, kompleks CoCL
2 .
6NH
3 ni hosil qildi.
Kompleks birikmalarni o’rganish shuni ko’rsatadiki, kompleks hosil bo’lishi
hodisasi ayrim elementlardagini uchramasdan balki D.I.Mendeliyev davriy
sistemasidagi ko’pchilik elementlarga mansub bo’lgan muhim hodisadir [6].
13](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_20.png?v=1)
![Kompleks birikma shunday birikmaki, uning molekulasi markaziy atomga ega
bo’lib, buni bir necha ion, yoxud molekulalar, ya’ni ligandlar qurshab turadi.
Ligand markaziy atom atrofida bitta yoki bir necha o’rin egallashi mumkin.
Masalan: Cl -
, Br -
, I -
, CO, H
2 O, NH
3 kabi ligandlarning har biri bittadan o’rin oladi.
Ular monodentat ligandlar deyiladi. Oksalat ioni, shuningdek etilendiamin
ikkitadan o’rin egallaydi. Bunday ligandlar bidentat ligandlar deyiladi.
Dietilentriamin uch dentatli ligand hisoblanadi. To’rt dentatli ligand uchun esa,
triaminotrietilamin misol keltirish mumkin.
Kompleks birikma hatto eritmalarda ham o’zining mustaqilligini saqlab
qolishga intiladi. Ionlarga oz darajadagina dissotsiyalanadi. Agar markaziy ionning
musbat zaryadi uni qo’rshab turgan ligandlar manfiy zaryadlarining yig’indisidan
ortiq bo’lsa, bunday kompleks-kation kompleks ; markaziy ionning zaryadi uni
qo’rshab turgan ligandlar manfiy zaryadlarining yig’indisidan kam bo’lsa, u holda
anion kompleks; markaziy ionning zaryadi bilan ligandlar zaryadlarining yig’indisi
orasidagi ayirma nolga teng bo’lsa, neytral kompleks birikmalar deb ataladi.
Kompleks birikmalar texnikada, meditsinada, qishloq xo’jaligida, ilm-fanda katta
ahamyatga egadir [12].
Kompleks birikmalar tabiatda ko’p tarqalgan. Masalan, o’simliklarning yashil
qismida bo’ladigan va fotosintezni amalga oshiruvchi modda xlorofill magniyning
kompleks birikmasidir.Tirik xujayralarni kislorod bilan taminlab turuvchi modda
qon gemoglabini temirning kompleks birikmasidir. Juda ko’p minerallar
alyuminosilikatlar kompleks birikmalardan iborat.
Kompleks birikmalar hosil qilish uchun birikish, almashinish, oksidlanish,
qaytarilish reaksiyalaridan foydalaniladi. Hosil qilingan kompleks birikmani
reaksion aralashmadan ajratib olish ham katta ahamyatga ega. Buning uchun:
1) Erituvchini bug’latish orqali konsentrlangan reaksion aralashma hosil qilib,
uni muz va tuz aralashmasi bilan sovutib, shu moddalar aralashmasidan kompleks
birikmani kristallga o’tkazishdan;
14](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_21.png?v=1)
![2) Reaksion aralashmaga kompleks birikmani eritmaydigan, lekin kompleks
hosil bo’lishida ishtirok etgan erituvchi bilan yaxshi aralashadigan boshqa biror
erituvchidan oz-oz qo’sha borishdan va ekstraksiya usulidan foydalaniladi.
Ba’zan kompleks birikma juda tez hosil bo’ladi. Masalan: CuSO
4 eritmasiga
NH
4 OH eritmasi qo’shilishi bilanoq, to’q zangori tusli kompleks [ Cu(NH
3 )
4 SO
4 ]
birikmasi hosil bo’ladi.
Reaksion aralashmaga etil spirit qo’shib, bu kompleks birikmani kristal holda
ajratib olish mumkin. Bu birikmada Cu 2+
markaziy ion, NH
3 -
molekulalari esa
ligandlardir [5].
Keyingi vaqtlarda metallarning kompleks birikmalarini tayyorlash uchun
suvsiz eritmalar ko’p qo’llaniladigan bo’ldi Masalan: CrCl
3 ning suvdagi
eritmasiga etelendiamin NH
2 -CH
2 -CH
2 -NH
2 qo’shilib, CrCl
3 .
3NH
2 -CH
2 -CH
2 -NH
2
tarkibli kompleks birikma hosil qilib bo’lmadi, lekin efirdagi eritmada bu
kompleks birikmani hosil qilib, kristall holida ajratib olish mumkin bo’ldi.
Kompleks birikmalarning o’ziga xos suyuqlanish, qaynash, parchalanish
temperaturalari, ma’lum erituvchilarda, xususan suvda eruvchanligi, elektir
o’tkazuvchanligi va boshqa xossalari bo’ladi.
Bular ichida tadqiqotchilar etiborini o’ziga jalb etadiganlari qatoriga;
komplekslarning tuzilishi, eruvchanligi, rangi, elektr o’tkazuvchanligi, oksidlanish
qaytarilish xossalari, spektrlari, magnet xossalari kiradi.
Kompleks hosil qiluvchi sistema rangining o’zgarishini tekshirish orqali
ko’pincha birikma tarkibini va uning barqaror yoki beqaror ekanligini aniqlash
mumkin.
Kompleks birikmalarning infraqizil nur yutishini o’rganish orqali birikma
tarkibidagi atomlararo bog’lanish xarakterini bilib olish mumkin.
U yoki bu elementning koordinatsion birikma hosil qilish qobilyati o’ta
element atomining sirtqi elektron qavati tuzilishiga va uning davriy sistemadagi
o’rniga bog’liq bo’lib, koordinatsion birikmalar hosil qiluvchilar jumlasiga asosan
sirtqi qavatda yetarli darajada bo’sh orbitallari bo’lgan metal ionlar kiradi.
Koordinatsion birikma hosil qiluvchi zarracha elektron juftining aksektori
15](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_22.png?v=1)
![vazifasini bajaradi. Agar markaziy atom kimyoviy bog’lanishda o’zining bo’sh s-
orbitallari bilan ishtirok etsa, bu holda faqat δ(sigma)-bog’lanish, agar bo’sh p-
orbitallar ham qatnashsa, δ- va π-bog’lanishlar yuzaga keladi(u p-, d-yoki f-
orbitallari bilan ishtirok etganida ham δ-va π-bog’lanishlar kelib chiqadi. Quyidagi
jadvalda markaziy atomlarning koordinatsion birikma hosil qilishda qanday
orbitallar hisobiga ishtirok etishi ko’rsatilgan [6], [27].
1-jadval
Kompleks birikma hosil qilishda qatnashadigan orbitallar turlari
Davrlar Markaziy
atomlar Qatnashadigan bo’sh orbitallar
s p d f
1
2
3
4
5
6
7 H-He
Li-Ne
Na-Ar
K-Kr
Rb-Xe
Cs-Rn
Fr-Ku +
+
+
+
+
+
+ -
+
+
+
+
+
+ -
-
+
+
+
+
+ -
-
-
-
-
+
+
Jadvaldan ko’ramizki, koordinatsion birikmalarning kompleks hosil qilishda
qatnashadigan bo’sh orbitallar soni davr raqami ortgan sari ortib boradi. I davr
elementlari koordinatsion birikma hosil qilishda faqat s-orbitallari bilan, II davr
elementlari s- va p-orbitallari bilan qatnashadi. Uchinchi va to’rtinchi davr
elementlarida s- va p- dan tashqari d-orbitallari ham, oltinchi va yettinchi davr
elementlarida bulardan tashqari yana f-orbitallar ham ishtirok etadi. Binobarin,
keyingi har qaysi yangi davrga o’tilganda oldingi davr elementlarining
koordinatsion birikma hosil qilish imkoniyati saqlanib qoladi [13].
Quyidagi 2-jadvalda markaziy atomga xos bo’lgan koordinatsion sonlar
keltirilgan.
16](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_23.png?v=1)
![2-Jadval
Markaziy atomga xos bo’lgan koordinatsion sonlar
Davr
lar Markaziy
atomlar Hosil bo’ladigan koordinasion birikmalarda markaziy atomning
koordinasion sonlari
2 3 4 5 6 Tekis
kvad. 7 8 9
1
2
3
4
5
6
7 H-He
Li-Ne
Na-Ar
K-Kr
Rb-Xe
Cs-Rn
Fr-Ku +
+
+
+
+
+
+ -
+
+
+
+
+
+ -
+
+
+
+
+
+ -
-
+
+
+
+
+ -
-
+
+
+
+
+ -
-
+
+
+
+
+ -
-
-
+
+
+
+ -
-
-
+
+
+
+ -
-
-
-
+
+
+
Jadvaldan ko’ramizki, bir davrdan ikkinchi davrga o’tilganda elementlarning
koordinatsion soni ortib boradi. Birinchi davr elementlarining koordinatsion soni 2
ga teng. Ikkinchi davr elementlari o’zining bitta s-va uchta p-orbitallar hisobiga
qatnasha oladi. Ularning koordinatsion soni 4 ga teng. Uchinchi davr
elementlarining atomlariga o’tilganda d-orbitallar ham ishtirok eta olishi sababli
ularning koordinatsion soni 6 ga teng bo’lishi mumkin (s, p va d-orbitallar
hisobiga), oltinchi va yettinchi davr elementlarining atomlari uchun yuqoriroq
qiymatga ega bo’lgan koordinatsion sonlar uchraydi [7], [8].
Ligandlar sifatida anionlar (F -
, OH -
, CN -
, SCN -
, NO
2 -
, CO
3 2-
, CrO
4 2-
va
hokazalar) neytral molekulalar (H
2 O, NH
3 , CO, N
2 , NO, N
2 H
4 , NH
2 -(CH
2 )
2 -NH
2 va
boshqalar) ishtirok etadi. Har bir ligandda bitta yohud bir nechta taqsimlanmagan
(erkin) elektron juft bo’ladi.ba’zan tarkibida taqsimlanmagan elektron juftlar
bo’lmagan, lekin p-bog’lanishda ishtiroki eta oladigan elektronlari bor molekulalar
ham ligandlik rolini bajaradi. Ligandning s- va p-orbitallari bilan markaziy
atomdagi bo’sh orbitallar o’zaro ta’sirlanishi natijasida δ-bog’lanish, ligandning p-
va d-orbitallari bilan markaziy atomning bo’sh orbitallari orasida π-bog’lanishlar
yuzaga chiqadi, (lekin s-va p
x -orbitallari o’zaro qoplanilaganda har doim δ-
17](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_24.png?v=1)
![bog`lanish hosil bo`ladi). Ligandlarning donorlik xossalari ulardagi s va p-
orbitallardagi elektron juftlar hisobiga; akseptorlik xossalari esa, bo’sh p-va d-
orbitallar hisobiga amalga oshadi [9].
Quyidagi jadvalda ligandlarning elektron donorlik vazifasini bajaruvchi
atomlar ko’rsatilgan [10], [11].
3-Jadval
Ligandalr va ularning elektron donor atomlari
Liganddagi
elektron
donor
atomlar Molekulyar turdagi ligandlar Ion turdagi ligandlar
monodentat polidentat monodentat polidentat
H, F, Cl, Br, I - - H -
, F -
, Cl -
,
Br -
, I - -
C CO, C
2 H
4 C
6 H
6 CN -
-
N NH
3 , C
5 H
5 N,
RCN, RNH
2 NH
2 (CH
2 )
2 -NH
2 NO
2 -
, N
3 -
,
SCN - -
O H
2 O R-CO-CH
2 -CO-R O -2
, OH -
CO
3 -2
, SO
4 2-
,
RCOO -
, C
2 O
4 -2
S R
2 S R-CHSH-CH
2 -
CHSH-R SCN, S -2
-
O yoki N -
ONO -
H
2 NCH
3 COO-
O va N - EDTA - -
S va N - - -
18](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_25.png?v=1)
![1.3. Koordinatsion birikmalar sinflari
Hozirda koordinatson birikmalar 4 sinfga bo’linadi:
A. Molekulyar monodentat ligandli koordinatsion birikmalar. Bular jumlasiga
ammiakatlar, gidratlar hamda metall korbonillar kiradi. Masalan [Cu(NH
3 )
4 ]SO
4 ,
[Al(H
2 O)
6 ]Cl
3 , [Ni(CO)
4 ], [Co
2 (CO)
8 ]
B. Ion ligandli koordinatsion birikmalar. Bularga ligandli kislota qoldig’idan
iborat atsedokomplekslar kiradi. Masalan: Na
3 [AlF
6 ], Na
2 [HgJ
4 ], Na
2 [PlBr
4 ],
K
4 [Fe(CN)
6 ], K
2 [BeF
4 ] va hokozolar. Okso- va gidroksokoordinatsion birikmalar
ham shu sinfga kiradi [14], [27].
C. Siklik koordinatsion birikmalar. Tarkibida bidentat va kolidentat ligandlar
bo’lishi mumkin. Masalan: [Co[NH
2 (CH
2 )
2 NH
2 ]
3 Cl
3 [Co(asos)
3 ] va hokozo. Agar
tarkibida 6 ta NH
3 ni uchta etilendiamik molekulasiga almashtirilsa [CoEn
3 ]Cl
3
hosil bo’ladi. Bunda har qaysi etilindiamin molekulasi metal bilan ikkima в - bog'
orqali birikadi. Natijada uchta besh a`zoli xalqaga ega bo’lgan kompleks birikma
hosil bo’ladi. (asos-atsetilatseton -O=C(CH
3 )–CH=C(CH
3 )-O -
anioni ham besh
a`zoli xaalqa hosil qiladi. Unda fragmentidan uchtasi markaziy atom atrofida
koordinatsiya holatida bo’ladi. Bunday birikmalar xelat koordinatsion birikmalar
deb ataladi:
Ikkinchi misol tariqasida ichki koordinatsion birikmalarni ko’rsatish mumkin.
Agar noligentat ligandning bir atomi markaziy atom bilan kovalent (ba`zan ionli)
tarzda birikib, ligandning ikkinchi atomi donor- akseptor mexanizm bo’yicha
markaziy atom bilan birikkan bo’lsa, hosil bo’lgan holatni–ichki koordinatsion
birikma deb ataladi. Masalan, glisen nomli aminokislota mis sulfat bilan
reaksiyaga kirishganida misning ichki kompleks birikmasi hosil bo’ladi [13]:
2NH
2 CN
2 COO + CuSO
4 →H
2 SO
4 +[Cu(NH
2 CH
2 COO)
2 ] Bis-glisinato mis(II)
kompleks birikmasi hosil bo’ladi [15].
19](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_26.png?v=1)
![Kompleksonlar, sendvich va π -komplekslar ham shu sinfga kiradi.
Etilendiamintetrasirka kislotasining ioni ham polidentat ligandlar jumlasiga kiradi.
Bu kislota qisqacha EDTA ya’ni EDTSK deb belgilanadi. Uning ikki natriyli tuzi:
Trilon-B nomi bilan analitik kimyoda metall ionlari miqdorini aniqlashda
ishlatiladi. EDTSK ning ioni olti dentatli ligand hisoblanadi. Agar metalning
koordinasion soni 6 dan ortiq bo’lsa, ortiqcha o’rinlarni erituvchi molekulalari
band qiladi [16].
Gemoglabin va xlorofil ham ichki kompleks birikmalar jumlasiga kiradi. Bu
ikki moddaning yadrosi bir xil tuzilishga ega. Gemoglabinda markaziy ion
vazifasini Fe(II), xlorofilda esa, Mg bajaradi.
D. Sendvich birikmalar. 1951 yilda ferrosen [Fe(C
5 H
5 )
2 ] sintez qilindi.
Keyinchalik uning sendvich (buterbrod) tuzilishga ega ekanligi isbotlandi. Uning
tarkibida temir ioni ikkita siklopentadienil ioni C
5 H
5 bilan birikkan. Uning
tuzilishini aniqlagan E.Fisher va J. Uilkonson Nobel mukofotini olishga sazovor
bo’ldilar. Ferrosendagi temir o’rnini boshqa metal, masalan, nikel egallashi
mumkin, u holda nikelosen [Ni(C
5 H
5 )
2 ] hosil bo’ladi. Bundan tashqari ferrosenning
siklopentadienil halqalari ham almashinish reaksiyalariga kirishadi.
Bu sinfga yana dibenzoxrom [Cr(C
6 H
6 )
2 ] ni ham kiritish mumkin. Oraliq d-
metallar bilan hosil qilingan karbosiklik birikmalar qatorida dibenzolxrom muhim
o’rin tutadi. U 1919 yilda sintez qilingan bo’lsada, uning tuzilishi faqat 1954 yilda
aniqlandi. Xayn xrom(III) xlorid bilan C
6 H
5 MgBr orasidagi reaksiyani amalgam
oshirib, xromning bir qancha birikmalarini olishga muvaffaq bo’ldi. Bu birikmalar
tarkibida xrom bilan sendvich tarzida birikkan benzol C
6 H
6 yoki difenil C
6 H
5 -C
6 H
5
molekulalari borligi aniqlandi. Keyinchalik dibenzolxrom metal galogenidiga
aromatic uglevodorodlarni Al kukuni va AlCl
3 ishtirokida bevosita ta’sir ettirish
orqali hosil qilinadigan bo’ldi.
20](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_27.png?v=1)
![Dibenzolxrom 284 0
C da suyuqlanadigan, suvda juda yomon, organic
erituvchilarda yaxshi eriydigan jigarrang tusli qattiq jism, diamagnit.
Dibenzolxromdagi kimyoviy bog’lanishda ikkita benzol molekulasining 12 ta π-
elektroni va xrom atomining 6 ta bo’sh orbitallari (donor-akseptor mexanizm
bo’yicha) ishtirok etadi; ikkinchi tomondan, xromdagi uchta electron juft benzol
molekulalaridagi bo’sh π-orbitallar bilan (dativ mexanizm bo’yicha) bog’lanadi.
Fe, Co, Ni, Mn, Cr, V, Ti, Ru, Th, va Os kabi metallarning siklopentadien
C
5 H
6 bilan birikmalari olingan. Bu koordinasion birikmalarni hosil qilish uchun
shu metallarga yoki ularning karbonillariga siklopentadien ta’sir ettiriladi. Natijada
Fe(C
5 H
5 )
2 ferrosen; Ni(C
5 H
5 )
2 nikelosen hosil bo’ladi. Metallarning siklopentadien
bilan hosil qilingan koordinasion birikmalari (shuningdek, dibenzolxrom Cr(C
6 H
6 )
2
kabi moddalar) ”sendvich-strukturali” moddalar nomini olgan, chunki bunday
koordinasion birikmalar rentgen nurlari yordamida tekshirilganida, ular xuddi ”ikki
burda orasidagi pishloq” kabi tuzilganligi, yani o’rtada metall atomi, uning ustuda
va tagida C
5 H
5 radikali joylanganligi ma’lum bo’ldi. Ferrosen molekulasining
tashqi qavatida 18 ta elektron bo’ladi. Ularning 8 tasi temirniki va 10 tasi ikkita
C
5 H
5 radikalnikidir. Ikkita C
5 H
5 radikali o’zining 10 ta p-elektroni hisobiga
koordinasion bog’ hosil qiladi. Shuning uchun oraliq metallarning sendvich
strukturali birikmalari π-koordinasion birikmalar jumlasiga kiradi.
Kompleks birikmalarning turlari. Biz yuqoridagi kompleks birikmalarni anion
kompleks, kation kompleks va neytral kompleks birikmalar deb 3 ta sinfga
bo’lishimiz mumkin. Lekin A. Verner nazariyasi yaratilgan vaqtda barcha
koordinasion birikmalarni ularning hosil bo’lish sxemasiga qarab quyidagi ikkita
katta sinfga bo’lishgan edi:
a) Biriktirib olish mahsulotlari.
b) Joylashishlar ya’ni singdirishlar mahsulotlari. Masalan: Agar BF
3 va HF
qo’shilsa, biriktirib olish mahsuloti hosil bo’ladi:
BF
3 +HF→H[BF
4 ]
Bu reaksiyaga BF
3 ga HF qo’shilganda F -
ioni ichki sferada qoladi.
21](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_28.png?v=1)
![Joylashish mahsulotlari: mis xloridga ammiak qo’shilganida mis bilan 2 ta
xlor ionlari orasiga ammiak go’yo ,,pona” bo’lib joylashadi [17].
CuCl
2 +4NH
3 →[Cu (NH
3 )
4 ]Cl
2
Reaksiya natijasida xlor ionlari mis ionidan uzoqlashib, koordinasion
birikmaning sirtqi sferasiga o’tadi.
Ba’zi koordinasion birikmalar borki, ularni ham biriktirish, ham singdirilish
mahsulotlari jumlasiga kiritish mumkin.
Hozirgi vaqtda kompleks birikma tarkibidagi ligandlarning xillariga qarab,
barcha kompleks birikmalarni quyidagi sinflarga ajratiladi:
1. Aminatlar va ammiakatlar. Bular o’zlarining ichki sferasida ammiak va
boshqa aminlar bo’lgan kompleks birikmalardir. Bu birikmalarda markaziy atom
bilan ligandlar, azot atomlari orqali bog’langan bo’ladi, ammiak molekulasining
har biri bittadan koordinatsion o’rinni egallaydi. Shuning uchun ichki sferada
bo’ladigan ammiak molekulalari soni markaziy ionning koordinasion soniga
bog’liq bo’ladi.
Mis, nikel, kobal’t kabi elementlar juda barqaror ammiakatlar hosil qiladi.
Organik aminlar etilen diamin NH
2 -CH
2 -CH
2 -NH
2 va peredin C
5 H
5 N juda ko’p
metallar bilan komplekslar hosil qiladi.
2. Gidratlar va akvokomplekslar. Anorganik moddalarda suv molekulasi bilan
birikib turg’unligi turlicha bo’lgan birikmalar hosil qilish hodisasi keng tarqalgan.
Ichki va tashqi sferasida suv bo’lgan kompleks birikmalar gidratlar deb ataladi.
Agar suv kompleks birikmada ligandlik rolini bajarsa, bunday birikmalar
akvokomplekslar deb yuritiladi.
Masalan: [Cu(H
2 O)
4 ]SO
4 .
H
2 O, [Co(H
2 O)
6 ]Cl
2 , [N:(H
2 O)
6 ](NO
3 )
2
Tuzlar gidratlarining kristall panjarasida suv molekulalari joylashib qoladi;
buning ikkita sababi bor: birinchisi-ion dipol tortilishi bo’lib, ikkinchisi-
mustahkam vodorod bog’lanishning mavjudligidir. Suv molekulalari ba’zi
kristalgidratlarda kristall panjara bo’shlig’ini to’latib, modda tuzilishini
mustahkamlaydi; aks holda, panjarada katta kation yoki anion borligi sababli
kristall oson emirilib ketadi.
22](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_29.png?v=1)
![Ko’pchilik kristalgidratlarda uchraydigan suv molekulalarining soni 2, 4, 6, 7,
8, 10 va 12 ga teng bo’lgan hollar ko’p uchrab turadi. Bu qatordan ko’rinadiki,
kristallgidratlarda suv molekulalarining soni markaziy ionning koordinasion soniga
teng bo’lavermaydi.
Kristallgidrat yoki koordinasion qavatga joylashgan suv molekulalarining
qizdirishga munosabati turlicha, koordinasion qavatdagi suv molekulalarining bug’
holga o’tishi uchun talab etiladigan temperatura gidratlangan holatdagi suv (105-
115 0
C) ga nisbatan yuqori temperaturani talab etadi. Birikmalardagi bunday suv
molekulalari farqini kimyoning termoanaliz sohasi o’rganadi.
3. Asidokomplekslar. Ligandlari kislota qoldig’idan iborat bo’lgan kompleks
birikmalar asidokomplekslar deb yuritiladi. Masalan: asidokomplekslar tarkibida
ikkita yoki uchta tur kislota qoldiqlari bo’lishi mumkin:
K
2 [Pt(NO
2 )
4 Br
2 ], K
4 [Fe(CN)
6 ], K
3 [Fe(CN)
6 ]
4. Poligalogenidlar. Markaziy ioni va ligandlari galogenlardan iborat
koordinasion birikmalar poligalogenidlar deb ataladi. Masalan; K[JJ
2 ]; K[ICl
4 ];
K[BrCl
2 ].
5. Polikislotalar. Bularni kislota molekulasiga shu yoki boshqa kislotaning
angidridi kelib qo’shilgan mahsulotlar deb qarash mumkin. Masalan, H
2 S
2 O
7 ham
polikislotadir, chunki u H
2 SO
4 ni SO
3 bilan to’yintirilganda hosil bo’ladi.
6. Siklik kompleks birikmalar. Ichki sferada sikllari bo’lgan komplekslar
birikmalar, siklik kompleks birikmalar deb yuritiladi.
7. Kompleks gidratlar. Kislotali va amfoter tabiatga ega bo’lgangidratlar asos
tabiatli gidritlar bilan suvdan boshqa erituvchilarda (masalan efirda) reaksiyaga
kirishsa, kompleks gidritlar hosil bo’ladi [18], [13].
LiH+BH
3 →Li[BH
4 ]; KH+AlH
3 →K[AlH
4 ]
8. Metall organik birikmalarga o’xshash komplekslar. Keyingi vaqtlarda
tarkibida organik ligandlar bo’lgan juda ko’p komplekslar hosil qilindi. Masalan:
Fe(C
5 H
5 )
2 va Cr(C
6 H
5 )
2 larni tuzilish formulasini quyidagicha ifodalash mumkin:
23](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_3.png?v=1)
![9. Metall korbanellar. Metallarning uglerod (II)- oksid bilan hosil qilgan
birikmalari korbonillar deb ataladi., masalan: Ni(CO)
4 .
Fe(CO)
5
10. Ko’p o’zakli komplekslar. Tarkibida ikkita va undan ortiq markaziy ionlar
bo’lgan komplekslar ko’p o’zakli kompleks birikmalar deb ataladi. Bu markaziy
ionlar bir-biri bilan O-H, O-O, NH
2 va NH kabi gruppalar orqali birikkan bo’ladi.
Masalan:
Ikki o’zakli kompleks birikmaga misol bo’la oladi. Bu yerda NH
2 (amin)
gruppa ko’prik vazifasini o’taydi. Ushbu kompleks birikma geksamin-M-amido-
M-digidroksokobalt (III) xlorid deb nomlanadi.
Biror kompleks birikma masalan: K
4 [Fe(CN)
6 ]↔4K +
[Fe(CN)
6 ] 4-
Bu jarayon xuddi kuchli elektrolitlarning dissosiyalanishi kabi sodir bo’ladi.
Ikkinchi navbatda kompleks ionning o’zi ketma-ket dissosiyalanadi:
[Fe(CN)
6 ] 4-
↔[Fe(CN)
5 ] 3-
+CN -
[Fe (CN)
5 ] 3-
↔[Fe(CN)
4 ] 2-
+CN -
va hakazo.
Umumiy disossiyalanish [Fe(CN)
6 ] 4-
↔Fe 2+
+6CN -
bilan ifodalanaladi.
Bu dissosiyalanish muvozanat holatga kelganda uning muvozanat konstantasi
kompleksning barqarorlik konstantasi deb yuritiladi.
Kompleks birikmalarning barqarorligi anchagina faktorlarga bog’liq bo’ladi.
Bunday birikmalarda tashqi va ichki sferalarning barqarorligi har xil bo’ladi.
Tashqi sferadagi kompleks ion elektrostatik kuchlar orqali bog’lanib, suvli
birikmalarda oson ajraladi. Bunday parchalanish birlamchi dissosiyalanish deyiladi
va u kuchli elektrolitlar kabi to’la ravishta o’tadi. Ichki sferada bo’lgan ligandlar
markaziy atom bilan ancha kuchli bog’langan bo’lib kam darajada ajraladi.
Kompleks birikmalarning ichki sferasidagi parchalanish ikkilamchi
dissosiyalanishi deb yuritiladi [19].
Birlamchi dissosiyalanish;
[Ag (NH
3 )
2 ]Cl ↔ [Ag(NH
3 )
2 +
+ Cl -
Ikkilamchi dissosiyalanish;
24](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_30.png?v=1)
![[Ag(NH
3 )
2 ] +
↔ Ag +
+ 2NH
3
Ikkilamchi dissosiyalanish kompleks zarrachaga markaziy ion va ligandlar
orasidagi muvozanat vujudga kelgandagina sodir bo’ladi. [Ag(NH
3 )
2 ] +
ionlar
dissosiyalanishi barcha kuchsiz elektrolitlar dissosiyalanishi kabi massalar ta’siri
qonuniga bo’ysunadi hamda muvozanat konstantasi yoki barqarorlik konstantasi
deyiladi:
K = [Ag +
] .
[NH
3 ] 2
/[[Ag(NH
3 ) 2
] +
] =6,8 .
10 -8
1.4. Koordinasion birikmalarni nomlanishi
Dastlab kompleks birikmalarni nomlashda ba’zan ularni rangidan yoki shu
moddani kashf etgan olim nomidan foydalanilgan. A. Verner komleks birikmalarni
nomlash uchun ”Ratsional nomenklatura” yaratdi. Ratsional nomenklatura
komplekslarning tarkibi va tuzilishlarini aks ettirishi kerak edi. Ya’ni kompleks
birikmaning nomi uning tabiatiga monand bo’lmog’i zarur edi. Tuzsimon
koordinasion birikmalarni ikki so’z bilan, noionogen birikmalarni bir so’z bilan
atash taklif qilingan [4].
Shuningdik ammiak- ,,amin”, suv-,,akvo” oltingugurt -,,tio”, OH- guruhi
bo’lsa ,,gidrokso”,-O-O-guruhi esa, ,,perokso”, kompleks birikma tarkibidagi xlor
esa ,,xloro”, ftor bo’lsa ,,ftoro” kabi so’zlar bilan ataladigan bo’ldi. Masalan:
K
4 [Fe(CN)
6 ] kaliy geksasiono temir(II).
1963-yildan boshlab, taklif qilingan nomenklatura xalqaro nazariy va amaliy
kimyo ittifoqi termin komissiyasi tomonidan tasdiqlangan.
1. Ionlarni nomlashda birinchi navbatda kation, undan keyin anion ataladi.
Masalan: [Ag(NH
3 )
2 ]Br - diamminargento (I) bromid
K
2 [CuCl
3 ] - kaliytrixloro mis (I)
2. Anionli kompleks birikmalarni nomlashda avval kation, anion so’ngra
neytral ionlar va undan keyin markaziy ion nomi ataladi (ular orasiga chiziqcha
qo’yilmaydi). Masalan: K
2 [Pt(NO
2 )
2 Cl
2 ] - kaliydixlorodinitroplatinat (II).
25](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_31.png?v=1)
![3. Legandlar sonini ifodalashda di-, tri-, tetra-, penta-, geksa- va hokazo
qo’shimchalar ishlatiladigan bo’ldi. Masalan: K
4 [Fe(CN)
6 ] - kaliy geksasianoferrat
(II), K
3 [Fe(CN)
6 ]-kaliy geksasianoferrat (III), [Al(H
2 O)
6 ]Cl
3 - geksaakvoalyuminiy
xlorid.
4. Markaziy ionning oksidlanish darajasini nomlashda; markaziy ionning
oksidlanish darajasi qavs ichida lotincha raqamlar bilan ifodalanadi. Masalan:
[Cu(NH
3 )
2 ] .
(OH)- diammin mis (I) gidroksid.
5. Ko’prik vazifasini o’tovchi gruppalarni nomlashda bir koordinatsion
markaz, ikkinchisi bilan bog’lab turuvchi ko’prik vazifasini bajarayotganda,
gruppalarni atashda, ularning oldiga μ harfi quyiladi. Masalan:
di- μ -gidroksooktaakvoditemir (II) xlorid yoki
di- μ -gidroksotetraoksalatodixromat (III) xlorid.
6. Geometrik izomerlarni nomlashda ularning ,,raqam” belgilaridan yoki ,,sis”
va ,,trans” termenlaridan foydalaniladi:
Transdixlordiammin palladiy (II) yoki 1,3-dixlordiammin palladiy.
Oktoedrik kompleks birikmalarni nomlashda ham ,,raqam” belgilaridan va ,,trans”,
,,sis” terminlaridan foydalaniladi. Masalan: sis-dibromotetraamminrodiy (III) yoki
1,2-dibromo-3,4,5,6-tetraammin rodiy(III) ioni deb nomlash mumkin.
26](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_32.png?v=1)
![Kompleks birikmalarda struktura izomeriya va sterso izomeriyalari bor.
Bularning birinchisida birorta legand ba’zi hollarda metal bilan koordinatsion bog’
orqali to’g’ridan-to’g’ri bog’langan bo’lsa, boshqalarida u kristal tuzining
koordinatsion ta’sir doirasidan tashqarida bo’ladi. Uning quyidagi kompleks
birikma [CrCl
3 (H
2 O)
6 ] misolida tushuntirish mumkin [20].
[Cr(H
2 O)
6 ]Cl
3 -binafsha rangli modda bo’lib, [Cr(H
2 O)
5 Cl]Cl
2 .
H
2 O va
[Cr(H
2 O)
4 Cl
2 ]Cl .
2H
2 O kompleks birikmalari esa, ko’k rangli moddalardir.
Lekin fazoda joylashuvi bo’yicha bir-biridan farq qiladi. Quyidagi ,,sis”
va ,,trans” kompleks birikmada xlor ligandlar bilan yonma-yon holda yoki qarama-
qarshi tomonlarga joylashishi mumkin.
Koordinasion sferada donor atomlarini turlicha joylashuvi hisobiga vujudga
keladigan izomerya geometrik yoki sis va trans izomerya deyiladi.Yuqorida
Pt(NH
3 )
2 Cl
2 kompleks birikmadagi geometrik izomerlarning ko’rinishi
tasvirlangan: a) sis-izomer va b) trans-izomerlar.
Bir-birining aksini ifodalovchi izomerlar optik izomerlar turiga kiradi. Optik
izomeriya deb molekulalari simmetriya markaziga yoki simmetriya tekisligiga ega
bo’lmagan va molekulyar massasi teng bo’lgan moddalarga aytiladi.
Optik faol birikmalar molekulalari simmetriya markaziga va simmetriya
tekisligiga ega bo’lmaydi. Optik faollikning sababi sifatida quyidagilarni ko’rsatish
mumkin:
1. Markaziy ion assimmetriya xususiyatiga ega bo’lishi.
2. Molekulaning ligandlari polidentat xususiyatiga ega bo’lishi sababli
assimmetriya paydo bo’ladi.
27](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_33.png?v=1)
![3. Ligand atomlaridan birining assimmetriyaga ega bo’lishi (masalan, optik
faol aminokislota koordinatsiyada qatnashgan holda) yoki koordinatsiyalangan
atomda yangi bog’ paydo bo’lishi tufayli assimmetriya holati paydo bo’ladi [16].
Optik izomeriya hodisasi koordinatsion ionnong fazoda turlicha joylanishidan
kelib chiqadi. Ayni koordinatsion birikmaning ikkala shakli bir xil molekulyar
elektr o’tkazuvchanlik va kislota-asoslik xossalarga ega bo’ladi. Lekin ular boshqa
optik faol moddalar bilan reaksiyaga kirishishi va birikishi jihatidan bir-biridan
farq qiladi. Masalan, [Coen
3 ]Br
3 koordinatsion birikmaning l-shakli l-kvadratga, d-
shakli esa d-kvadratga birikadi [17], [21].
Optik izomeriya ham koordinatsion birikma tarkibidagi atomlarning fazoda
boshqa-boshqa tarzda joylashishi natijasida hosil bo’ladi. To’rtta ligandi bir-
biridan farq qiladigan tetraedik tipdagi kompleks [M(ABSD)] ni ko’rib chiqaylik.
Bu shakllarning biri ikkinchisi ustiga qo’yilganida ularning ayrim o’xshash
nuqtalari bir-birini qoplamaydi. M(ABSD) tarkibli tetraedrik koordinatsion
birikma ichki simmetriya tekisligi mavjud emas. Bu koordinatsion birikmaning
markazini kesib o’tgan tekislikning ikkala yon tomonida ham ikktadan turli xil
ligandlar joylashgan bo’ladi.
1.5. Koordinasion birikmalarni kimyoviy bog’lanish tabiati
A.Verner nazariyasi asosida qo’shimcha valentlik haqidagi tasavvurga
asoslanib, koordinasion birikmalarning mavjudlik sababini va stereokimyosini
izohlab berish mumkin. Lekin koordinasion bog’lanishdagi asosiy va qo’shimcha
valentliklarning ma’nosi faqat elektron nazariya asosidagina to’la tushuntiriladi.
Shuningdek, ba’zi koordinasion birikmalarda ligandlar neytral molekulalar
(masalan; H
2 O, NH
3 , CO, C
2 H
5 , C
2 H
4 , C
6 H
6 va hokazolar) bo’lishi mumkin.
Bunday koordinasion birikmalarda markaziy atom bilan ligandlar orasida donor-
akseptor (ba’zan dativ) bog’lanish mavjud. Ba’zi koordinasion birikmalarda
markaziy atom rasmiy nol valentli bo’ladi, masalan; Cr(C
6 H
6 )
2 , Cr(CO)
6 , Fe(CO)
5 ,
Ni(CO)
4 , Co
2 (CO)
8 kabi birikmalarda markaziy atom bilan ligandlar orasida dativ
bog’lanish hosil bo’ladi [14], [22].
28](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_34.png?v=1)
![Koordinasion birikmalarda bog’lanish xarakteri (kovalentlik yoki ionli
darajasi) markaziy atom xossasiga ham bog’liq bo’ladi. Koordinasion birikmalarda
biror ligand bilan markaziy ion orasidagi bog’lanishning nisbiy mustahkamligi
o’sha ligandga nisbatan trans-holatda turgan boshqa ligand tabiatiga bog’liq.
Koordinasion birikmalarda bo’ladigan kimyoviy bog’lanish dastlab Kossel va
Lyuis nazariyalari asosida talqin qilindi. Keyinchalik bu haqda uchta nazariya
yaratildi:
1. Valent bog’lanish yoki atom orbitallar metodi
2. Kristall maydon nazariyasi
3. Molekulyar orbitallar metodi (ligandlar maydoni nazariyasi).
Kristall maydon nazariyasiga ko’ra d-elektronlar ligandlar band etgan joylarni
band qilmaslikka intiladi. Bu nazariyaga ko’ra markaziy atom bilan ligandlar
orasida ion bog’lanish yoki ion-depol bog’lanish yuzaga keladi. Bu nazariya
markaziy atomning kvant-mexanik tuzilishini hisobga oladi, lekin ligandlarni hech
qanday strukturaga ega bo’lmagan shunchaki zaryadli nuqtalar deb qaraydi; ularni
faqat elektrostatik maydon yaratuvchi zaryadli zarrachalar deb tassavvur qiladi.
Koordinatsion birikmalar kimyosining muhim qoidallar: 1. Peyrone
qoidasi. Atsidokomplekslar ammiak yoki aminlar bilan reaksiyaga kirishganida
sis-izomer holatidagi mahsulotlar hosil bo’ladi.
Masalan: agar eritmada kaliy tetraxloroplatina (II) - K
2 [PtCl
4 ] ning 1 mol
miqdoriga 2 mol ammiak qo’shsak, sis-dixlorodiamminplatina hosil bo’lib, KCl
ajralib chiqadi:
2. Iorgensen qoidasi. Ammiakatlar kislotalar ta’sirida parchalanganida,
ko’pincha, trans-izomer holatidagi atsidobirikmalar hosil bo’ladi. Masalan,
tetramminplatina (II) xlorid [Pt(NH
3 )
4 ]Cl
2 ni HCl bilan parchalaganimizda trans-
dixlordiamminplatina (II) hosil bo’ladi:
29](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_35.png?v=1)
![3. L. A. Chugayev 1906-yilda tarkibida besh va olti a’zoli halqalari bo’lgan
koordinatsion birikmalar eng barqaror bo’ladi, degan qoidani tarifladi.
To’rt a’zoli halqaga ega bo’lgan koordinatsion birikmalar kamroq mustahkam
bo’ladi, uch a’zoli halqasi bo’lgan koordinatsion birikmalar beqarordir. Masalan,
platinaning etilendiaminli birikmasi [Pt(NH
2 -(CH
2 )
2 -NH
2 )
2 ]Cl
2 tarkibida ikkita
besh a’zoli halqa bor:
Bu birikma nihoyatda barqaror; unga HCl ta’sir ettirsak ham parchalanmaydi.
Ikki valentli nikelning glioksimli birikmasida ikkita besh va ikkita olti a’zoli
halqalar borligi uchun bu birikma juda ham barqarordir:
Bu birikma hatto HCl bilan qaynatilganda ham parchalanmaydi; uni faqat
konsentrlangan nitrate kislota va zar suvi (3HCl+HNO
3 ) gina yemiradi.
4. N. C. Kurnakov qoidasi. Trans- va sis-shakllaridagi koordinatsion
birikmalarni bir-biridan ajratish katta ahamiyatga ega.
Tekshirishlar natijasidan ma’lumki, ayni koordinatsion birikmaning trans-
shakli uning sis-shakliga qaraganda yomon eriydi.
30](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_36.png?v=1)
![Trans- va sis-shakllarni bir-biridan farq qilishda N. S Kurnakov qoidasi
yordam beradi. N. S. Kurnakov sis- va trans-diaminlarning tiokarbamid SC(NH
2 )
2
bilan reaksiyaga kirishishini tekshirdi, natijasida sis-izomerdagi ligandlarning
tiokarbamidga to’liq almashinishi aniqlandi:
Trans-izomeriyasida esa, ligandlar tiokarbamidga to’liq almashinmaydi, balki
turli ligandli (aralash ligandli) koordinatsion birikmalar hosil bo’ladi [23], [26]:
L. A. Chugayev o’zining xalqali koordinatsion birikmalar haqidagi qoidasini
tajribada hosil qilingan mahsulotlarni sifat jihatidan tekshirish ma’lumotlari
asosida tariflagan edi. XX asrning 40-yillaridan boshlab bu sohada miqdoriy
ma’lumotlar olinadigan bo’ldi. Shvarsenbax 1952-yilda amaliy natijalarni
umumlashtirib, xelat effekt qoidasini quyidagicha tarifladi. Siklik koordinatsion
birikma M[AA] ning hosil bo`lish konstantasidan nosiklik koordinatsion birikma
[MA 1-
2 ] ning hosil bo`lish konstantasidan bir necha marta kattadir (A`-xossalari
AA ning xossalariga yaqin bo`lgan monodentat ligand, AA esa- bidentat ligand).
Misol tariqasida 2 ta koordinatsion birikmani ko`rib chiqamiz; biri nosiklik
koordinatsion birikma [Ni(NH
3 )
6 ]Cl
2 uning suvdagi eritmada hosil bo`lish
konstantasi K=5 .
10 9
, ikkinchisi siklik koordinatsion birikma [NiEn
3 ]Cl
2 , uning ayni
sharoitda hosil bo`lish konstantasi K=2 .
10 19
. Binobarin, xelat koordinatsion
31](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_37.png?v=1)

![xos ba’zi hodisalarni - Kurnakov, Peyrone, Iorgensen qoidalarini, Pt(II) va Pt(IV),
Pd(II), Co(II) va Cu(II) birikmalarida qo’sh kristallanish natijalarini tushuntirishda
yordam beradi. Bu qonuniyat asosida kompleks ionning ichki qobig’ida
almashinish reaksiyasining yo’nalishini, izomerlarda ba’zilarining turg’unligini,
izomerlarning bir-biridan ayrim xossalari (elektr o’tkazuvchanlik, optik va kislota-
asoslik xossalari bilan farq qilishini tushuntirish mumkin. Masalan;
Koordinasion birikmalarda molekulalari bir-biridan Cl-Pt-Cl va Br-Pt-Br
koordinatidagi trans- aktiv ligandlari bilan farq qiladi. Ularning ekvimolyar
miqdordagi aralashmasining eritmasidan kristall holda olingan. Modda quyidagi
tarkibga ega:
Hosil bo’lgan trans- holatdagi xlor bilan Pt zaif bog’langanligi sababli unda
quyidagi reaksiya kuzatiladi:
Bu qonuniyat asosida ba’zi aralashma ligandli kompleks birikmalarning hosil
bo’lmasliklarini tushuntirish mumkin. Masalan, [PtCl
4 ] 2-
ning eritmasiga
tiomochevina qo’shilganda PtCl
2 (Thio)
2 birikma eritmada hosil bo’lishi noma’lum,
buning sababi sis-holatda Thio molekulasi joylashgan modda hosil bo’lmaydi,
33](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_39.png?v=1)
![Thio ning trans- ta’siri kuchli bo’lishi Cl -
ning markaziy atom bilan bog’lanishida
ionli darajaning kuchayishiga va shu tufayli qo’zg’aluvchan bo’lishiga olib keladi.
Bu qonuniyat tarkibi [PdCl
3 (NO
2 )] 2-
bo’lgan moddaning uchta xlor ionlaridan biri
almashinish reaksiyasida qatnashganda faqat trans-aktiv NO
2 -
qarshisidagi Cl -
,
tarkibi [PdCl
3 (NH
3 )] -
bo’lgan molekulasida almashinish jarayoni (bir mol ”kirib
keluvchi” modda bilan bir mol kompleks ion qatnashganda) NH
3 ga nisbatan trans
holatda joylashgan Cl -
ioni qatnashishini oldindan aytishga imkon beradi.
1.6. Elektrostatik (Kossel va Magnus) nazariyasi
Markaziy ion ligandlarni Kulon qonuniga muvofiq elektrostatik kuch bilan
tortadi; ligandlar esa bir-biriga elektrosta tik qarshilik ko’rsatadi. Kossel va magnus
fikricha n ta manfiy bir zaryadli ionlar bilan neytrallangan n ta zaryadli musbat
zarracha yana boshqa manfiy zarrachalarni o’ziga tortish qobiliyatini yo’qotmaydi.
Biroq bu vaqtda markaziy ion bilan ligandlar orasida o’zaro tortishuv va manfiy
zarrachalar orasida o’zaro tortishish kuchlari hosil bo’ladi. Bu nazariyada har qaysi
ion elastik shar deb qaraladi. Sharlarning markazlari orasidagi masofa qo’shni
ionlar radiuslari yig’indisi (r
1 +r
2 ) teng deb olinadi. Manfiy ionlar orasidagi o’zaro
qarshilik kuchini markaziy ion bilan ligandlar orasidagi o’zaro tortishish kuchiga
nisbati ayni sistemaning niqoblanish (ekranlanish) koeffitsienti (HK) deb ataladi.
Biror koordinatsion sistema hosil bo’lganida ajralib chiqadigan energiyaning
miqdori shu sistemaning niqoblanish koeffitsientiga bog’liq bo’ladi.
Ba’zi oraliq elementlarning birikmalari uchun Kossel va Magnus tenglamasi
asosida hisoblab topilgan bog’lanish energiyalarining qiymati tajribada topilgan
qiymatga mos kelmadi. Shu sababli Bete va Van-Flek elektrostatik nazariya
o’rniga kristall maydon nazariyasini taklif qildilar.
Kompleks birikmalar gal’vanik qoplamalar hosil qilishda ham katta
ahamiyatga egadir. Buning uchun ishqoriy metallarning sionitlari eritmalariga mis,
rux, oltin va boshqa metallarning sionitli komplekslari K
2 [Cu(CN)
3 ],
Na
2 [Zn(CN)
4 ], K[Au(CN)
4 ] qo’shiladi.
34](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_4.png?v=1)
![Sianli elektrolitlar zaharli bo’lgani uchun ularni boshqa tuzlarga almashtirish
zarurati tug’ilgan. Masalan, K
2 [Cu(CN)
3 ] o’rnida misning etanolaminli kompleks
tuzi K
2 [Cu(H
2 NCH
2 CH
2 O)
4 ] qo’llanilmoqda.
Po’lat zanglashini kislotali muhitda susaytirish uchun urotropin bilan kaliy
yodit aralashmasi qo’shiladi. Bunda [Fe{(CH
3 )
2 NH}
6 ]I
2 tarkibli, kislotada
erimaydigan kompleks birikmasi hosil bo’ladi.
1.7. Kovalent bog’lanish nazariyasi
Lyuis nazariyasiga muvofiq kovalent bog’lanish hosil bo’lganida o’zaro
birikuvchi atomlar orasida umumlashgan elektron juftlar hosil bo’ladi. Koordina-
sion kovalent bog’lanishda esa, elektron juftlar reaksiyadan oldin o’zaro birikuvchi
zarrachalarning birida bo’ladi, keyin keyin umumiy bo’lib qoladi (donor-akseptor
bog’lanish). Masalan, ammiak kislotalar bilan reaksiyaga kirishganda ammiakning
azot atomidagi elektron jufti vodorod ioni bilan ammiak o’rtasida umumiy bo’lib
qoladi. NH
4 +
dagi barcha N-H bog’lanishlar bir-biridan sira farq qilmaydi [24].
Bu reaksiyada ammiak molekulasidagi azot atomi donor, vodorod ioni esa
akseptor vazifasini bajaradi. Ammiak molekulasi o’zining elektron juftini
vodoroddan boshqa ionlarga ham berishi mumkin. Masalan:
G. Lyuis bu reaksiyalarni kislota bilan asosning o’zaro ta’sirlanish reaksiyasi
deb qaradi. G. Lyuis nazariyasiga muvofiq, kislota deganda o’ziga elektron
juftlarni qo’shib olish qobilyatiga ega bo’lgan moddani tushinish kerak; asos esa
o’zidan elektron juftlar berishga qobil moddadir. Yuqoridagi misolda Cu 2+
kislota
va NH
3 asos rolini bajaradi. Lyuis nazariyasining koordinatsion birikmalarga oid
qismlarini Sidjvik rivojlantirdi. Uning fikricha, koordinatsion birikmalar hosil
bo’lganda markaziy ionning barcha ionlari bilan ligandlar bergan barcha
elektronlar yig’indisi (bu yig’indi effektiv atom raqami nomini olgan) ayni
markaziy ionga yaqin turgan inert gazning tartib raqamiga teng bo’lishi kerak.
35](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_40.png?v=1)
![Masalan, K
4 [Fe(CN)
6 ] dagi Fe 2+
ionining 24 elektroni bor, unga birikkan 6 ta CN -
ionida 12 elektron bor, ularning yig’indisi 24+12=36 dir. Bu son kriptonning tartib
raqamiga teng.
Sidjvik nazaryasi juda sodda va tushunarli bo’lib ko’rinsa ham juda ko’p
koordinatsion birikmalarning tuzilishini to’g’ri izohlay olmadi va uning o’rnini
valent bog’lanishlar nazariyasi egalladi.
Valent bog’lanishlar nazaryasiga muofiq, koordinatsion birikmalarda
markaziy ion bilan ligandlar orasida donor-akseptor bog’lanish hosil bo’ladi:
markaziy ion akseptor, ligandlar donor vazifasini bajaradi, bu nazarya markaziy
ion orbitallarining gibridlanishi ham nazarda tutiladi.Nazarda tutiladi ham emas,
hatto muhim ahamyatga ega.Gibridlanish konsepsiyasi koordinatsion birikmalar
uchun L.Poling tomonidan rivojlantirildi. Bu konsepsiya, koordinatsion
birikmalarning struktur formulalarni valent bog’lanishlar usuli asosida izohlashga
imkon beradi [25].
Metall atomidagi elektron juftning ligand atomiga o’tishi natijasida hosil
bo’lgan bog’lanish donor-akseptor bog’lanish ko’rinishining bir turi bo’lganligi
uchun uni dativ p-bog’lanish (yoki p-donor bog’lanish ) deb ataladi. Dativ p-
bog’lanish p-orbitallar ishtirokida ham borishi mumkin. Lekin d-orbitallar
ishtirokida borgan p-donor bog’lanish birmuncha pishiq bo’ladi.
Endi [Co(NH
3 )
6 ] 3+
tarkibli koordinatsion ionning hosil bo’lishini ko’rib
chiqamiz: bu ion hosil bo’lishida ham Co 3+
orbitallari gibridlanadi; bu holda ikkita
3d-, bitta 4s-, va uchta 4p orbitallar bir-biri bilan qo’shilib oltita yangi d 2
sp 3
gibrid
orbitallarni hosil qiladi va ularni har biriga bittadan ammiak taqsimlanmagan
elektron juftlari joylashib, Co 3+
ion olti juft elektron qabul qiladi.
Bunday koordinatsion ion hosil bo’lishida markaziy ionning sirtqi qavatidagi
s- va p-orbitallari bilan birga ichki qavatning d-orbitallari ishtirok etgani uchun
[Co(NH
3 )
6 ] 3+
ichki orbital komplekslar jumlasiga kiradi. Bu koordinatsion ionda
bironta ham toq elektron yo’q. Shuning uchun bu koordinatsion ion diamagnit
xossaga ega.
36](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_41.png?v=1)
![Valent bog’lanishlar nazaryasi asosida koordinatsion birikmalarning
reaksiyalarda ishtirok etish qobilyatini oldindan aytish mumkin. Koordinatsion
birikmalarning ichki sferasidagi ligandlarning eritmalarda boshqa ligandlarga
(ya’ni boshqa ion yoki molekulalarga) almashinish tezligi koordinatsion
birikmaning ichki yoki tashqi orbital birikmasi ekanligiga va uning tarkibidagi
ichki d-orbitalning elektron bilan to’lgan to’lmaganligiga bog’liq.
Kompleks birikmalarni xalq xo’jaligidagi ahamiyati. Xalq xo’jaligida
katta ahamiyatga ega bo’lgan ko’pgina organik moddalar ham kompleks
birikmalardan
iboratdir. Ular jumlasiga gemoglabin, xlorofil, ferment, vetaminlar va boshqa
moddalar kiradi. Kompleks birikmalar turli sohalarda keng qo’llaniladi [4].
1. Ular ionlarni (Fe 2+
, Fe 3+
, Ni 2+
, Co 3+
) aniqlash uchun analitik kimyoda
ishlatiladi. Masalan:
3FeCl
2 +2K
3 [Fe(CN)
6 ]→Fe
3 [Fe(CN)
6 ]↓+6KCl
4FeCl
3 +3K
4 [Fe(CN)
6 ]→Fe
4 [Fe(CN)
6 ]
3 ↓+12KCl
Analitik kimyoda metallarni aniqlashda, kompleksonlar ta’sir ettirib, kompleks
birikmalar hosil qilinadi. Hosil bo’lgan kompleks birikma eritma holida(fotometrik
usulda) cho’kma holida (tortma analiz) o’rganiladi. Kuchsiz ishqoriy muhitga ega
bo’lgan nikel (II) –sulfat eritmasiga 3-4 tomchi dimetilglioksim qo’shilganda ko’k-
qizil kristal hosil bo’ladi:
CH
3 - C = NOH
+ NiSO
4 + 2NH
4 OH → (NH
4 )
2 SO
4 + 2H
2 O + [NiC
4 H
6 N
2 O
2 ]
CH
3 - C = NOH
Bu reaksiya Chugayev reaksiyasi nomi bilan yuritiladi. Nekilni modda
tarkibida bor yo’qligini aniqlash uchun natriy giksonitrokobaltiat (III) ishlatiladi.
3KCl+Na
3 [Co(NO
2 )
6 ]→K
3 [Co(NO
2 )
6 ]+3NaCl
2. Ba’zi metallarni bir-biridan ajratish va yuqori darajada toza metallar (oltin,
kumush va hakozolar) olish uchun kompleks birikmalardan foydalaniladi.
Masalan: Kvars va qumdan oltinni ajratib olishda ko’pincha oltinning kislorod
ishtirokida natriy sianit bilan kompleks tuz hosil qilishdan foydalaniladi. Chunki
37](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_42.png?v=1)
![oltin kislorod ishtirokida NaCN bilan suvda yaxshi eriydigan kompleks birikma
hosil qiladi.
4Au+8NaCN+O
2 +2H
2 O→4Na[Au(CN)
2 ]+4NaOH
Eritmaga o’tgan kompleks tarkibidagi oltinni rux yordamida erkin holda
ajratib olish mumkin.
2Na[Au(CN)
2 ]+Zn→Na
2 [Zn(CN)
4 ]+2Au
3. Kompleks birikmalardan bo’yoq moddalar sifatida foydalaniladi. Tarkibida
temir tuzlari bo’lgan zangori bo’yoq 1704-yilda Dispax tomonidan qora mol qonini
potash (K
2 CO
3 ) bilan qizdirish natijasida hosil qilingan. Zangori bo’yoq
K
4 [Fe(CN)
6 ]+Fe 3+
→KFe[Fe(CN)
6 ]+3K +
tarkibli kompleks birikmadir.
Bu modda lak bilan aralashtirib ishlatiladi. Hozirgi vaqtda xrom, kobalt va
misning organik moddalar bilan hosil qilgan bo’yoqlari ko’p ishlatilmoqda.
4. Kompleks birikmalar o’simlik va hayvonot olamida muhim rol o’ynaydi.
Uzoq vaqt mobaynida o9’simlik, hayvonot va odam organizmida kimyoviy
jihatdan biologik sistemalar bunyodga kelgan. Bularning ko’pchiligini metal
organik birikmalar tashkil qiladi. Tirik organizmlarda uchraydigan eng sodda
komplekslar metallarning aminokislotalar bilan hosil qilgan komplekslaridan
iboratdir. Ular tarkibidagi aminokislota ikki dentalli ligand vazifasini bajaradi.
Ularning formulalarini quyidagicha yozish mumkin:
Bu birikmada ligand o’zining tabiati jihatidan besh a’zoli qilib, bidentat
birikma yotganligi yuqoridagi formuladan ko’rinib turibdi. Bu kompleks
birikmalarning barqarorligi quyidagi tartibda oshib boradi:
Ca 2+
< Mg 2+
< Mn 2+
< Fe 2+
< Co 2+
< Zn 2+
<Ni 2+
<Cu 2+
Bu metallardan organizmning boshqa murakkab birikmalari xlorofil va
gemoglabinlar hosil bo’ladi. Vitaminlarning ba’zilari kompleks birikmalar
tarkibiga kiradi. Ular tirik organizm hayotida muhim ahamiyatga ega. Akademik
38](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_43.png?v=1)
![A. A. Grenberg tashabbusi bilan professor M. A. Azizov rahbarligida Toshkentda
biologik jihatdan faol bo’lgan kompleks birikmalar o’rganishga kirishildi.
Ligandlar sifatida aminokislotalar markaziy atom sifatida kobalt, temir, rux kabi
metallardan foydalanildi. Sintez qilingan kompleks birikmalarning ko’pchiligi
tibbiyot uchun katta ahamiyatga ega bo’lgan dorivor priparatlardir. Masalan:
nikotin kislota va kobalt (II) xloriddan hosil qilingan modda ,,koalid“ va
[Pt(NH
3 )
2 Cl
2 ] tarkibli kompleks birikmasi sariq qon kasalligini davolashda zaruriy
dori sifatida ishlatilmoqda.
Analitik kimyoda kompleks birikmalarning ahamiyati. Bunday birikmalar
elementlarning modda tarkibida bor-yo’qligini bilishda (sifat analizi), modda
tarkibining qancha foizini tashkil etishini aniqlashda (miqdoriy analiz) va
elementlarni bir-biridan ajratish (ekstraksiya) maqsadida ishlatiladi.
Ko’pchilik kationlar tuzlari aralashmasiga etarli miqdorda ammiak eritmasi
ta’sir ettirilganda kationlar gidroksidlar holida cho’kmaga tushadi. Bunda Cu 2+
,
Ag +
, Zn 2+
, Ni 2+
, Co 2+
kabi ionlarning gidroksidlari mo’l ammiak eritmasida erib
ketib, [Cu(NH
3 )
4 ] 2+
, [Ag(NH
3 )
2 ] +
, [Zn(NH
3 )
4 ] 2+
, [Ni(NH
3 )
6 ] 2+
ga o’tadi, Co 2+
esa
kislorod ishtirok etmaganda [Co(NH
3 )
6 ] 2+
tarkibli kompleks ionlarini hosil qiladi.
Co 2+
kislorod ishtirok etganda esa Co 3+
ionining bir necha ammiakatlari hosil
bo’ladi.
Bazi kompleks ammiakatlar o’ziga xos rangga ega bo’ladi: bu rangga qarab
ayni kompleksni hosil qilgan metallarning miqdorini aniqlash mumkin. Masalan,
rangsiz yoki suvda erimaydigan asoslar hosil qiluvchi tuzlar aralashmasida mis
bor-yo’qligini aniqlash uchun shu eritmaga mo’l miqdorda ammiak eritmasi
qo’shilganda cho’kma hosil bo’ladi. Uni filtrlab ajratilganda yashil zangori rangli
filtrat hosil bo’ladi. Bu filtratga [Cu(NH
3 )
4 )] 2+
tarkibli kompleks ioni o’tadi; uni
kolorimetrik usulda tekshirib aralashmada bo’lgan mis miqdorini aniqlash
mumkin. Kaliy ionini aniqlash uchun Na
3 [Co(NO
6 )] tarkibli, temir Fe 2+
ionini
aniqlashda K
4 [Fe(CN
6 )], Na +
ioni uchun UO
2 (CH
3 COO)
2 . Mg(CH
3 COO)
2 , Zn 2+
uchun (NH
4 )
2 [Hg(CNS)
4 ] tarkibli kompleks tuzlaridan reaktiv sifatida
foydalaniladi.
39](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_44.png?v=1)
![Hozirgi vaqtda metall ionlarini aniqlash uchun tarkibida maxsus atomlar
gruppasi bo’lgan reaktivlar qo’llaniladi. Metallarni aniqlashda, asosan tarkibida bir
necha karboksil gruppalari bor α- aminokislotali reaktivlar ishlatilmoqda. Ana
shunday birikmalardan biri sifatida imin-di-sirka kislota HOOCCH
2 -NH-
CH
2 COOH ni aytib o’tish mumkin.
Ana shu kislotaning hosilasi etelendiamintetrasirka kislota va uning 2ta
vodorod atomi natriyga almashingan tuzi NaOOCCH
2 -NaOOCCH
2 -N-CH
2 -CH
2 -N-
CH
2 COOH-CH
2 COOH trilon-B nomi bilan ataladi. Bu birikma, masalan, kalsiy
bilan reaksiyaga kirishganda o`zidagi ikkita natriy atomini kalsiy atomiga
almashtiradi, natijada xelat koordinatsion birikma hosil bo`ladi. U uch valentli
kationlar bilan ham shunga o`xshash tuzlar hosil qiladi.
Trilon-B kompleksonlar nomli reaktivlar jumlasiga kiradi. Trilon-B eritmada
bo`lgan metall ionning hammasi bilan mustahkam birikma hosil qila oladi. Bunday
reaksiyalarni o`rganishda indikator sifatida mureksid va qora erioxrom ishlatiladi.
Kimyo laboratoriyalarida metallarni aniqlash uchun ko`p qo`llaniladigan
reaktivlar jumlasiga kupferon H-O-NC
6 H
5 -N=O, 8-oksixinolin C
9 H
6 NOH va
ditizon C
6 H
5 -NH-NH-CS-NH-NH-C
6 H
5 lar kiradi.
Koordinatsion birikmalar galvanik qoplamalar hosil qilishda ishlatiladi.
Oddiy tuzlarning eritmalari galvanik qoplamalar hosil qilishda ishlatilganda yirik
kristall cho’kmalar hosil bo’lib, qoplama oson ko’chib ketadigan bo’ladi. Lekin bu
maqsad uchun kompleks tuzlarning eritmalari ishlatilsa, mayda kristalli juda zich
qoplamalar hosil bo’ladi.
Galvanik qoplamalar hosil qilish uchun ishqoriy metallarning sianitlari
eritmalariga mis, rux, oltin va boshqa metallarning sianidli komplekslari
K
2 [Cu(CN)
3 ], Na
2 [Zn(CN)
4 ], K[Au(CN
4 ] qo`shiladi.
Sianli elektrolitlar zaxarli bo’lganligi uchun ularni boshqa tuzlarga
almashtirish zaruratu tug’ulgan. Masalan, K
2 [Cu(CH)
3 ] o’rnida misning
etanolaminli kompleks tuzi K
2 [Cu(H
2 NCH
2 CH
2 OH
4 )] qo’llanilmoqda.
Metallarni koorroziyadan saqlashda kompleks birikmalarning
ahamiyati. Metall sirtiga yaxshi yopishadigan (ya’ni kuchli adgeziyaga ega
40](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_45.png?v=1)
![bo’lgan) koordinatsion birikma metallini eritmada va atmosferada (ochiq havoda)
koorroziyadan saqlashga imkon beradi. Masala, po’lat buyum, natriy benzoat
C
6 H
5 COONa eritmasi ichiga solib qo’yilsa, temir buyum sirtida ko’zga
ko’rinmaydigan himoya parda hosil bo’adi. Uning tarkibi Fe[(C
6 H
5 COOH)
6 ] .
(OH)
3
dan iborat. Uning borligini elektronogeafik va kimyoviy usullar bilan isbotlash
mumkin:
4Fe+24C
6 H
5 COONa+30H
2 O+3O
2 →24NaOH+4[Fe(C
6 H
5 COOH)
6 ](OH)
3
Benzitriazol kadmiy, rux va mis ionlari bilan suvda kam eriydigan cho’kmalar
hosil qilishi sababli metallarni koorroziyadan himoya qiladi.
Eritmadagi pH o’zgarganida metall sirtida hosil bo’lgan kompleks
birikmaning barqarorligi o’zgaradi; buning natijasida koorroziya tezligi ham
o’zgaradi. Kumush va qo’rg’oshin metallari sirtiga kaliy uch yodid (Kl
3 ) ning
suyultirilgan eritmasi ta’sir etganida suvda erimaydigan qavat hosil bo’lib, bu
qavat metallarning yanada koorroziyalanishdan himoya qiladi. Lekin bu qavat Kl
ning konsentrasiyalangan eritmasida erib ketadi:
AgJ+KJ=K[AgJ
3 ]; PbJ
2 +KJ=[PbJ
3 ]
Ko’p hollarda metallar ishqor ta’siridan koorroziyaga uchraydi. Buning sababi
shundaki, metall ishqor ishtirokida suvda yaxshi eruvchan komplekslar hosil
qiladi, masalan:
Fe+2NaOH+2H
2 O→Na
2 [Fe(OH)
4 ]+H
2
Havo kislorodi ishtirokida esa suvda yaxshi eriydigan Na
4 [Fe(OH)
7 ] va
Na
5 [Fe(OH)
8 ] tarkibli komplekslar paydo bo’lib, temirning zanglashi tezlashadi.
Ishqor konsentratsiyasi kamaytirilganda kompleks yemirilib, koorroziya
sustlashadi: [Fe(OH)
7 ] 4-
→Fe(OH)
3 +4OH -
Po’lat zanglashini kislotali muhitda susaytirish uchun urotopin bilan kaliy
yodid aralashmasi qo’shiladi. Bunda [Fe{(CH
3 )
2 NH}
6 ]I
2 .
I
2 tarkabli, kislotada
erimaydigan kompleks hosil bo’ladi.
Porfirining markaziy atomi temir (Fe 2+
) bo’lganida bu modda gemoxromogen
deb ataladi. Gemoxromogen oqsil molekulalari bilan birgalashib, gemoglobin hosil
qiladi. Qizil qon tanachalari tarkibiga kiruvchi gemoglobin o’pkadan hujayralarga
41](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_46.png?v=1)
![kislorod va aksincha, to’qimalardan CO
2 ni o’pkaga olib boruvchi transport
vositasidir. Gemoglabin oqsil modda-globin va prostetik gruppa-gemdan iboratdir.
Gem esa protoporfirin bilan koordinatsion bog’ vositasida bog’langan Fe(II) ionini
tutgan kompleks birikmadir [28].
Kompleks birikmalar elementlarning modda tarkibida bor-yo’qligini bilishda
(sifat analizi), modda tarkibining qancha foizini tashkil etishini aniqlashda
(miqdoriy analiz) va elementlarni bir-biridan ajratish (ekstraksiya) maqsadida
ishlatiladi.
Trilon-B kompleksonlar nomli reaktivlar jumlasiga kiradi. Trilon-B eritmada
bo`lgan metall ionning hammasi bilan mustahkam birikma hosil qila oladi. Bunday
reaksiyalarni o`rganishda indikator sifatida mureksid va qora erioxrom ishlatiladi.
Kimyo laboratoriyalarida metallarni aniqlash uchun ko`p qo`llaniladigan
reaktivlar jumlasiga kupferon H-O-NC
6 H
5 -N=O, 8-oksixinolin C
9 H
6 NOH va
ditizon C
6 H
5 -NH-NH-CS-NH-NH-C
6 H
5 lar kiradi.
Metall-fermentlar (enzimlar). Fermentlar tirik organizmda sodir bo’ladigan
kimyoviy reaksiyalarni tezlashtiruvchi biologik katalizatorlardir. Hozirgacha
ma’lum bo’lgan fermaentlar soni ikki mingdan ortiq. Ularning hammasi oqsil
tabiatli va boshqa turdagi moddalar kofermerlaridan tarkib topgan o’zaro kimyoviy
bog’larsiz birlahgan komplekslardan iboratdir. Fermentlarda unumli va tanlab
ta’sir qilish xususiyati yuqori, ularda sharoitga qarab aktivligi o’zgaruvchan
xususiyatlar mavjud. Fermentlar ta’sir qiladigan modda(substarat) larning
kimyoviy o’zgarishi oddiy reaksiyalarga nisbatan 10 8
-10 12
marta tezlashishi
mumkin.
Fermentlarning tanlab ta’sir etishini odam sulak bezida ishlab chiqariladigan
amilaza organizmda kraxmal, glikogen va ularga yaqin bo’lgan polisaxaritlarning
gidroliz reaksiyasini tezlashtirishda, hujayralarda polisaxaritlarning yig’ilishini
ta’minlaydi. Lekin bu ferment saxarozani parchalanishiga ta’sir etmaydi.
Odatda ferment molekulasi tarkibiga bir necha metall atomlari kirishi
mumkin, ular fermentlarning o’zgarmas tarkibiy qismini tashkil etadi. Bunday
metall atomlari ferment bilan substrat orasida kompleks hosil qiladi; bu holat
42](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_47.png?v=1)
![substrat bilan fermentning aktiv markazi orasida bog’lovchi vosita bo’lishi
ko’pchilik tatqiqotlarda aniqlangan. Hozirgacha erkin holatda ajratib olingan
metall fermentlar soni 50 tadan ortadi. Metall fermentlar tarkibida Ca, Mn, Fe, Cu,
Zn, Cr va Mo borligi aniqlangan. Ba’zan aktiv fermentlar tarkibida Co ioni
uchraydi, lekin u rux ionini almashtirishi mumkin, bunda fermentning aktivligi
o’zgarmay qoladi. Metall ferementlarda ko’pincha, rux, temir va mis uchrab turadi.
Tarkibida rux bo’lgan metall fermentlar soni 20 dan ortiq bo’lsada, ulardan faqat 2
tasi yaxshi o’rganilgan. Birinchisi-karboangidraza; uning molekulyar massasi-30
mingga yaqin; bu fermentning bitta molekulasi tarkibiga bitta rux atomi kiradi. Bu
ferment qizil qon tanachalari tarkibida uchraydi. U gidrokorbonat ionning
degidratlanishida va CO
2 ning gidratlanish reaksiyasida katalizatorlik rolini
bajaradi.
Ikkinchisi karboksipeptidaza, uning molekulyar massasi 34 mingga yaqin, bir
molekulasi tarkibiga 1 ta rux atomi kiradi. Bu ferment sut emizuvchilarning
oshqozon ostidagi bezida-peptid zanjirining karboksil qismidagi peptil
bog’lanishida sodir bo’ladigan gidroliz jarayonini katalitk tezlashtiradi; sodir
bo’ladigan reaksiyani quyidagicha yozish mumkin:
R″- CH
2 CONH - CHR′ - CONH - CH
2 COO -
+ H
2 O →
R″CH-CONH-CHR′-COO -
+H
3 +
NCH
2 COO -
Tarkibida mis bo’lgan metal-fermentlar, asosan oksidazalar bo’lib, ular oksidlanish
reaksiyalarida katalizatorlik vazifasini bajaradi.
Kompleks birikmalar kimyosi, asosan markaziy zarracha va uni qurshab olgan
ligandlardan iborat ion va molekulalarni o’rganadi. Markaziy zarracha vazifasini
metal ionlari yoki UO
2 2+
ioni kabi oksokationlar, ligandlar vazifasini esa anorganik,
organic yoki element organik moddalarning molekula yoki ionlari bajaradi.
Markaziy zarracha va u bilan bevosita birikkan ligandlar birga qo’shilib
kompleksning ichki sferasini tashkil etadi [16], [18].
Tipik markaziy ionlar jumlasiga d- va f-elementlarning ionlari kiradi. Ishqoriy
va ishqoriy-yer metallari eng kuchsiz kompleks hosil qiluvchi hisoblanadi.
43](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_48.png?v=1)
![Kompleks hosil qiluvchi elementlar D.I.Mendeleev davriy jadvalining IV-VI
qo’shimcha gruppalariga joylashgan d-elementlar hamda lantanoid va
aktinoidlardir.
Barcha ligandlar o’zining molekular tuzilishiga muofiq: anionlar (yoki
atsidoligandlar), molekular ligandlar (H
2 O,NH
3 ,CO), sikl hosil qiluvchi (xelat)
ligandlar (NH
2 -CH
2 -CH
2 -NH
2 ), siklik (masalan,C
5 H
5 ) ligandlar va makrosiklik
liganlar nomi bilan yuritiladi. Ligandlarning tabiatiga muofiq koordinatsion
birikmalar turli sinflarga bo’linadi [19], [29].
Markaziy zarrachaning koordinatsion soni deganda ayni zarracha (ligand)lar
soni tushuniladi. Agar markaziy zarracha bilan ligand orasida ikki markaziy
bog’lanish mavjud bo’sa, uning koordinatsion soni δ-bog’lanishlar soniga teng
bo’ladi. Koordinatsion sferada har qaysi ligand egallagan o’rinlar soni –ayni
ligandning koordinatsion sig’imi yoki uning dentatligi deb ataladi. Bir dentatli
ligand yadro atrofida faqt birgina o’rin oladi (Br -
, I -
, CN -
,SCN -
,CO, H
2 O,NH
3 lar
bir dentatli ligandlardir). Oksalat ion C
2 O
4 2-
va etildiamin H
2 N-CH
2 -CH
2 -NH
2 -ikki
dentatli ligandlar jumlasiga kiradi. Etilendiamin tetrasirka kislota anioni esa
polidentatli ligand hisoblanadi. Ligandning dentatligi va markaziy atomning
koordinasion soni doimiy (o’zgarmas) qiymatlar emas. Ularning qiymatlari
zarrachalarning katta-kichikligiga, ular orasidagi bog’lanishning turiga va
hokazolarga bog’liq; 2,4,6 ga teng koordinasion sonlar juda ko’p uchraydi [20].
Eritmalarda koordinasion birikmalar hosil bo’lganida erituvchining
molekulalari ichki sfera tarkibiga kirishi mumkin. Masalan, HgCl
2 ning organik
moddadagi eritmasiga LiCl qo’shilganda [HgCl
3 L] -
tarkibli tetraedrik koordinasion
ion hosil bo’lganligi nurning kombinasion yoyilishiga asoslangan spektroskopik
tekshirishlar natijasida isbot qilingan (L – organik erituvchi molekulasi).
Koordinasion birikmalarning kimyoviy reaksiyaga kirishish kinetikasi asosida
ularni ”inert” va ”labil” komplekslar deb ikki gruppaga ajratiladi. Labil kompleks
ion reaksion muhit bilan dinamik muvozanatda turadi. Ularda ligandlararo
almashinish reaksiyalari tez sodir bo’ladi. Inert kompleks ionida bunday
reaksiyalar sust boradi. Lekin cho’kma hosil bo’ladigan, ligand parchalanadigan
44](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_49.png?v=1)
![reaksiyalar va assosiyalanish hamda oksidlanish-qaytarilish reaksiyalari-inert
komplekslarda ham tez sodir bo’lishi mumkin [24].
Inert va labil tushunchalarini kompleksning barqaror va beqaror tushunchalari
bilan aralashtirib yubormaslik kerak. Barqaror va beqaror tushunchalarni ionning
termodinamika jihatidan mustahkamligini ifodalaydi. Masalan, [Co(NH
3 )
6 ] 3+
tarkibli inert koordinasion ion kislotali muhitda termodinamik jihatdan beqaror
bo’lib, uning turg’unlik konstantasi K=3,2 .
10 10
ga teng. Lekin, [HgJ
4 ] 2-
tarkibli labil
koordinasion ionning eritmada juda barqaror, uning turg’unlik konstantasi juda
katta (K=2,4 .
10 29
) [23], [30].
Ba’zi koordinasion birikmalar (masalan, Al va Cu ning asitelasetonatlari,
ferrosen va boshqalar) qizdirilganda ham parchalanmay haydaladi. Bu va shunga
o’xshash hodisalar gaz fazada ham koordinasion birikmalar hosil bo’lishidan darak
beradi. Mass. spektrometriya usuli yordamida aniqlanishicha MgCl
2 650 0
C da
sublimatlanganida gaz holda MgCl
2 dan tashqari Mg
2 Cl
4 , Mg
3 Cl
6 va nihoyatda oz
miqdorda Mg
4 Cl
8 molekulasi ham bo’lar ekan. Gaz muhitida koordinasion
birikmalar hosil bo’lishi zarrachalar orasida elektrostatik o’zaro ta’sirlashish
eritmalardagiga qaraganda ancha kuchliroq namoyon bo’ladi (chunki gaz muhitda
dielektrik holat bo’lishi bunday ta’sirlashish oson sodir bo’lishiga olib keladi). Gaz
muhitda koordinasion birikmalar hosil bo’lishi yuqori temperaturada sodir
bo’lganligi sababli, bu jarayonda entropiya o’zgarishi manfiy qiymatga ega:
∆S=∂G/∂T. Buning oqibatida jarayonning izobar potensiali ortib boradi, lekin
kompleks birikmaning barqarorlik konstantasi temperatura ortgan sari kamayadi.
Tashqi koordinasion sferaga ega bolgan koordinasion birikmalar qutbli
erituvchi muhitda avval birlamchi dissotsiyalanishga uchraydi; bunda tashqi
sferadagi ionlar kompleksdan batamom ajralib ketadi, masalan:
[Cu(NH
3 )
4 ]Cl
2 = [Cu(NH
3 )
4 ] 2+
+2Cl -
So’ngra ikkinchi qatra (solvolitik) bosqichli dissotsiyalanish sodir bo’ladi;
[Cu(NH
3 )
4 ] +2
+L→[Cu(NH
3 )
3 L] 2+
+NH
3 +L→[Cu(NH
3 )
2 L
2 ] 2+
+NH
3 +L→[Cu(NH
3 )L
3 ] 2+
+NH
3 +L→[CuL
4 ] 2+
+NH
3
45](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_5.png?v=1)
![Bu yerda: L-qutbli erituvchi molekulasi [suv, spirt, DMFA, DMCO-(CH
3 )
2 SO va
hokazo].
Ichki koordinasion birikmalar (masalan, kompleksonatlar, ditizonatlar,
porferinlar) dissotsiyalanganda solvo-protolitik (ya’ni ham erituvchi ham protonlar
ishtirok etadigan) jarayon sodir bo’ladi.
Komplekslarning tuzilishi endilikda valent bog’lanishlar, kristall maydon va
molekulyar orbitallar nazariyalari asosida talqin qilinmoqda [21], [22], [30].
Koordinasion birikmalar quyidagi jarayonlarda ko’p ishlatiladi:
a) analitik kimyoda ko’pgina elementlar atomlari ionlarining yoki organik
moddalarni tahlilida (asosan fotokolorimetrik usulda),
b) ba’zi metallarni aralashmalaridan ajratib olish va ularni yuqori darajada
tozalash,
v) galvonostegiya va galvonoplastinkada mustahkam qoplamalar hosil
qilish,
g) bo’yoq moddalar tayyorlash (berlin siri va boshqalar),
d) suvning qattiqligini aniqlash va uni bartaraf etish (polifasfatlar,
poliaminokislotalar, kompleksonlar va boshqalar),
e) tirik organizmning hayotiy jarayonida muhim bo’lgan birikmalar
(gemoglabin, enzimlar, xlorofill va boshqalar) koordinasion birikmalar
jumlasidandir.
46](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_50.png?v=1)
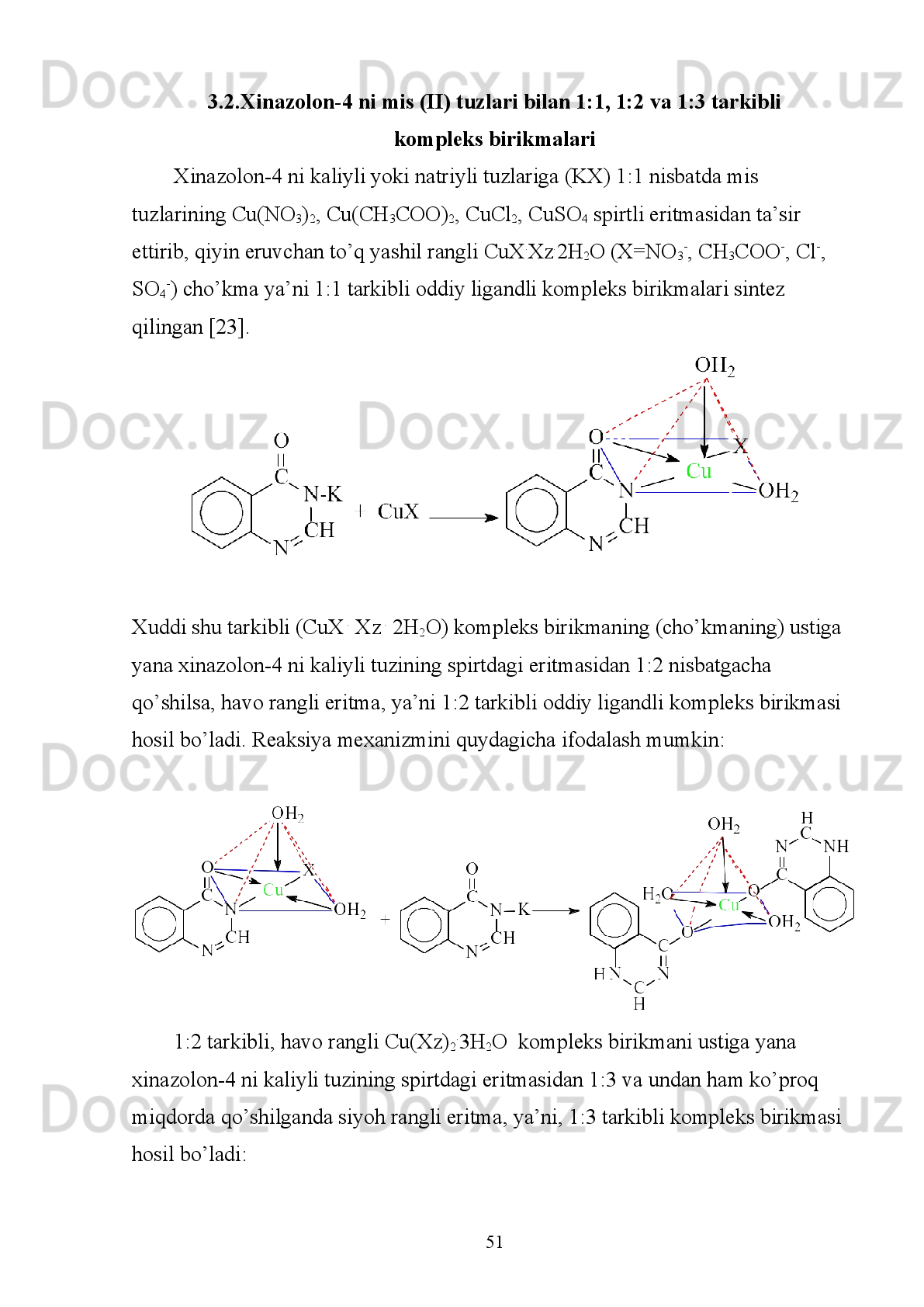
![(1mol) KTX 5ml metanoldagi eritmasini oz-ozdan qo’shganimizda dastlabki to’q
yashil cho’kma erib ketadi va asta-sekin kul rang cho’kma, ya’ni Cu(Xz)
(TXz) .
H
2 O kompleks birikmasi hosil bo’ladi. Cho’kma filtrlanib, suvli spirt bilan
bir necha marta yuviladi va quritiladi.
Reaksiya unumi -73% T 0
suyuq.=320 0
C.
Cu(Xz) .
(OXz) .
2H
2 O tarkibli aralash ligandli kompleks birikmasini sintez
qilish uchun 0,334 gr (1mol) CuNO
3 .
Xz .
2H
2 O kompleksini 10 ml metanoldagi
eritmasiga 0,200 gr (1mol) KOXz ni 10 ml metanoldagi eritmasidan qo’shilganda
dastlab to’q yashil cho’kma erib ketadi va oradan 3-5 minut o’tgach ko’k rangli
cho’kma ya’ni Cu(Xz)(OXz) .
2H
2 O kompleks birikmasi hosil bo’ladi. Cho’kma
filtrlanib suvli spirt bilan yuviladi va xona haroratida quritiladi.
Reaksiya unumi - 66%, T 0
suyuq. 370 0
C.
2.3. Xinazolon-4 va uning 2-tiokso-5, 7-dimetil pirido [2,3-d] pirimidinon-4
hosilasini mis (II) tuzlari bilan aralash ligandli kompleks birikmasi sintezi
Cu(Xz) .
(TPP) .
H
2 O kompleks birikmasini sintez qilish uchun 0,242 gr
Cu(NO
3 )
2 .
3H
2 O tuzini metanoldagi eritmasiga tomchilatib aralashtirgan holda
qo’shganimizda to’q yashil cho’kma hosil bo’ladi. CuNO
3 .
Xz .
2CH
3 OH kompleks
birikmasining ustiga 0,216 gr KTPP 5 ml metanoldagi eritmasini oz-ozdan
qo’shganimizda dastlabki to’q yashil cho’kma erib ketadi. Asta-sekin kul rang
cho’kma ya’ni Cu(Xz)(TPP) .
H
2 O kompleks birikmasi hosil bo’ladi. Cho’kma
filtrlanib, suvli spirt bilan bir necha marta yuviladi va quritiladi.
Reaksiya unumi-73%, T 0
suyuq. 312 0
C.
2.4. Xinazolon-4 va uning 2-aminohosilasini mis(II) tuzlari bilan
aralash ligandli kompleks birikmasi sintezi
Cu(Xz) .
(Axz) .
H
2 O kompleks birikmasini sintez qilish uchun 0,334gr (1 mol)
CuNO
3 .
Xz .
2CH
3 OH kompleks birikmasini 10ml spirtdagi suspenziyasiga 0,200
gr(1 mol) aminoxinazolonning kaliyli tuzini 5 ml spirtdagi eritmasini tomchilatib
qo’shganimizda, dastlabki havo rangli kompleks birikmasining rangi to’q ko’k
48](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_52.png?v=1)

![III BOB. OLINGAN NATIJALAR VA ULARNING TAHLILI
3.1. Xinazolon-4 va uning kaliyli hamda natriyli
tuzlarini sintezlash usullari
Xinazolon-4 va uning hosilalari tarkibida donor atomlarining (N, S, O)
bo`lishi, ularning har xil tautomeryalarga uchrashi va shu donor atomlar hisobiga
metallar bilan har xil koordinatsiyaga uchrashi ham nazariy, ham amaliy jihatdan
qiziqish uyg`otadi. Xinazolon-4 oq kristal modda bo`lib, bir qancha tautomeriya
holatlarida bo`lishi mumkin:
Tajribalar natijasi A:B:C=7:2:1 nisbatlarda bo`lishi aniqlangan [18].
Xinazolon-4 ni spirtli eritmada 1:1 nisbatda ishqor ta`sir ettirilib, xinazolon-
ga nisbatan eruvchan bo`lgan kaliyli va natriyli tuzlarini olish mumkin:[23]
50](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_54.png?v=1)
![3.2.Xinazolon-4 ni mis (II) tuzlari bilan 1:1, 1:2 va 1:3 tarkibli
kompleks birikmalari
Xinazolon-4 ni kaliyli yoki natriyli tuzlariga (KX) 1:1 nisbatda mis
tuzlarining Cu(NO
3 )
2 , Cu(CH
3 COO)
2 , CuCl
2 , CuSO
4 spirtli eritmasidan ta’sir
ettirib, qiyin eruvchan to’q yashil rangli CuX .
Xz .
2H
2 O (X=NO
3 -
, CH
3 COO -
, Cl -
,
SO
4 -
) cho’kma ya’ni 1:1 tarkibli oddiy ligandli kompleks birikmalari sintez
qilingan [23].
Xuddi shu tarkibli (CuX .
Xz .
2H
2 O) kompleks birikmaning (cho’kmaning) ustiga
yana xinazolon-4 ni kaliyli tuzining spirtdagi eritmasidan 1:2 nisbatgacha
qo’shilsa, havo rangli eritma, ya’ni 1:2 tarkibli oddiy ligandli kompleks birikmasi
hosil bo’ladi. Reaksiya mexanizmini quydagicha ifodalash mumkin:
1:2 tarkibli, havo rangli Cu(Xz)
2 .
3H
2 O kompleks birikmani ustiga yana
xinazolon-4 ni kaliyli tuzining spirtdagi eritmasidan 1:3 va undan ham ko’proq
miqdorda qo’shilganda siyoh rangli eritma, ya’ni, 1:3 tarkibli kompleks birikmasi
hosil bo’ladi:
51](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_55.png?v=1)
![Yuqorida sintez qilingan uchala kompleks birikmalarning infra-qizil spektrlari
o’xshash bo’lib, liganddagi ν(C=O) 1710 sm -1
dan 1690 sm -1
gacha kamayishi N-H
bog’larini valent tebranishlariga tegishli yutilish chiziqlarini 3200 sm -1
da
kompleks birikmalarning IQ-spektrlarida kuzatilmasligi xinazolon-4 ni mis metali
bilan uchinchi holatdagi azot va to’rtinchi holatdagi kislorod orqali bidentat
birikayotganligidan dalolat beradi [20], [21], [26].
1:1, 1:2 va 1:3 tarkibli kompleks birikmalar hosil bo’lganligini ranglarni
o’zgarishidan, cho’kma tushushidan, elementga analiz qilish bilan hamda IQ-
spektrlaridagi nur yutilish chiziqlarini intensivliklarini taqqoslash bilan aniqlash
mumkin.
Xinazolon-4 va uning kompleks birikmalarini
ba’zi bir fizik-kimyoviy xossalari 4-Jadval
№ Birikmalar Rangi Molekulyar
massasi Elementlarning miqdori (%)
Me C N S H
1 Xinazolon-4 oq 146 - 65,05
65,75 19,24
19,17 - 4,2
4,3
2 CuNO
3 .
Xz .
2H
2 O To’q
yashil 306 20,63
20,91 31,14
31,37 13,75
13,72 - 3,0
2,9
3 Cu(Xz)
2 .
3H
2 O Ko’k 406 15,32
15,76 47,03
47,29 13,56
13,80 - 3,9
3,9
4
Cu(Xz)(TPP) .
H
2 O Kul
rang 432 14,81
14,77 50,00
49,94 12,96
12,88 7,4
7,8 3,7
3,9
5 Cu(Xz)(OXz) .
2H
2 O Och
ko’k 404 16,76
16,85 47,81
47,72 13,84
13,82 - 3,4
3,2
6 Cu(Xz)(TXz) .
H
2 O Kul
rang 403 15,68
15,88 43,31
43,64 13,77
13,82 7,89
7,94 2,8
2,9
7 Cu(Xz)(AXz) .
H
2 O To’q
ko’k 386 16,12
16,18 49,42
49,64 18,33
18,82 - 3,4
3,2
52](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_56.png?v=1)
![Misli kompleks birikmalarning EPR- spektrlari o’rganilib, hosil bo’layotgan
anizatrop parametrlari (g
‖ =2,221, A=13g va g
┴ =2,067) o’rganildi. Misli kompleks
birikmalarni kvadratli piramida tuzilishiga ega ekanligini IQ-spektridan olingan
ma’lumotlar ham tasdiqlaydi. Hosil bo’lgan kompleks birikmalarning elektr
o’tkazuvchanligi o’rganilib, kam elektr o’tkazuvchan ekanligi (18÷25 sm -1.
om 2
.
mol -1
) aniqlangan [4].
3.3. Cu(Xz) (TXz) .
H
2 O va Cu(Xz)(OXz) .
2H
2 O-kompleks
birikmalarining IQ-spektri
Aralash ligandli kompleks birikmalarning IQ-spektrida koordinatsiyaga
uchragan xinazolon-4 ni xarakterli chiziqlari deyarli uchramay qoladi.
Koordinatsiyaga uchragan 2-oksoxinazolon-4 da esa, ligandli uchinchi holatdagi ν
(NH) 3
chiziqlar 3060 sm -1
oblastida kuzatilmadi. Oksoxinazolon-4 ni ikkinchi
holatda 1698 sm -1
da uchraydigan ν (C=O) 23 sm -1
past chastotali sohada ya’ni
1675 sm -1
da kuzatildi. Koordinatsiyaga uchragan suv molekulalariga tegishli keng
chiziqlar esa, 3400-3450 sm -1
oblastida nur yutilish chiziqlari kuzatildi [30].
Misli kompleks birikmalarning EPR- spektrlari o’rganilib, hosil bo’layotgan
anizatrop parametrlari (g
‖ =2,221, A=13g va g
┴ =2,067) o’rganildi. Misli kompleks
birikmalarni kvadratli piramida tuzilishiga ega ekanligini IQ-spektridan olingan
ma’lumotlar ham tasdiqlaydi.
Olingan natijalarga asoslanib, kompleks birikmaning tuzilish formulasini
quyidagicha ifodalash mumkin:
53](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_57.png?v=1)
![Cu(Xz)(TX) .
H
2 O kompleksining IQ-spektrida 2-tioksoxinazolon-4 ni
uchinchi holatidagi ν(N-H) ga tegishli nur yutilish chiziqlarini 3200 sm -1
oblastida
kuzatilganligi va to’rtinchi holatidagi ν(C=O) ga tegishli yutilish chiziqlarini 1710
sm -1
dan 30 sm -1
ga ya’ni 1680 sm -1
gacha kamayishi 2-tioksoxinazolon-4 ni mis
metali bilan uchinchi holatdagi azot va to’rtinchi holatdagi kislorod orqali bidentat
koordinatsiyaga uchrayotganidan dalolat beradi.
Sintez qilingan kompleks birikmalar spirt, suv, DMFA va DMCO larda juda
yaxshi eriydi.
3.4. Cu(Xz)(TPP) .
H
2 O –kompleks birikmasining IQ-spektri
Cu(Xz)(TPP) .
H
2 O kompleks birikmasining IQ-spektrida 2-Tiokso-5,7-
dimetilpirido[2,3-d] pirimidinon-4 (TPP) ni uchinchi holatdagi ν(N-H) ga tegishli
nur yutilish chiziqlarini 3200 sm -1
oblastida kuzatilmasligi va to’rtinchi holatdagi
ν(C=O) ga tegishli nur yutilish chiziqlarini 1710 sm -1
dan 30 sm -1
ga ya’ni 1680
sm -1
gacha kamayishi TPP ni mis metali bilan 3-holatdagi azot va to’rtinchi
holatdagi kislorod orqali to’rt xalqali metallosikl hosil qilgan holda, bidentat
koordinatsiyaga uchrayotganligidan dalolat beradi [22].
54](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_58.png?v=1)
![Sintez qilingan kompleks birikmalar spirt, suv, DMFA va DMSO larda juda
yaxshi eriydi.
3.5. Cu (Xz) (AXz) .
H
2 O-kompleks birikmasining IQ-spektri
Bu kompleks birikmaning IQ-spektriga ligandning spektrida namoyon
bo’layotgan ν (NH) 3
va ν (C=O) 4
ga tegishli nur yutilish chiziqlari 3060 va 1695
sm -1
oblastida kuzatilmadi. 3410 sm -1
oblastida ν(NH) -1
gruppaga tegishli nur
yutilish chiziqlari namoyon bo’ladi, u liganddagiga nisbatan (15 sm -1
) pastgi
oblastga siljigan.
ν(C=N) Aromatik xalqaga tegishli keng nur yutilish chiziqlari 1595-1620 sm -1
oblastida kuzatildi. 1390 va 835 sm -1
oblastida neytral ionlarining ν
2 , ν
3 valent
tebranishlariga tegishli yutilish chiziqlar kuzatildi. ν(C-O) ga tegishli yutilish
chiziqlari esa, 1345 sm -1
da kuzatildi. Suv molekulalariga tegishli bo’lgan ν(OH)
3450-3500 sm -1
oblastida keng chiziqlar tarzida namoyon bo’ldi [28], [29].
Misli kompleks birikmalarning EPR- spektrlari o’rganilib, hosil bo’layotgan
anizatrop parametrlari (g
‖ =2,221, A=13g va g
┴ =2,067) o’rganildi. Misli kompleks
birikmalarni kvadratli piramida tuzilishiga ega ekanligini IQ-spektridan olingan
ma’lumotlar ham tasdiqlaydi. Hosil bo’lgan kompleks birikmalarning elektr
o’tkazuvchanligi o’rganilib, kam elektr o’tkazuvchan ekanligi (18÷25 sm -1.
om 2
.
mol -1
) aniqlangan [4].
Cu(Xz)(AXz) .
H
2 O kompleks birikmasining elektron spektrini o’rganish
uchun, kompleks birikmani dimetilsulfooksid (DMSO) dagi eritmasini KFK-3 da
to’lqin uzunligi 315 nm dan 900 nm gacha bo’lgan oblastlarda tekshirib chiqdik.
55](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_59.png?v=1)
![Kompleks birikmasining elektron spektrida 340 nm va 680 nm larda nur
yutilishi kuzatildi. Ligandga tegishli bo’lgan yuitilish chiziqlari pastki oblastda
(290-300) nm namoyon bo’lishi adabiyotlardan ma’lum.
Demak, kompleks birikmaning elektron spektrida namoyon bo’layotgan 340
nm ligandni mis metali bilan birikishi natijasida yuqori oblastga (290 nm dan 340
nm gacha ) siljiganligini ko’rsatadi ( ya’ni L→Me) [8].
Kompleks birikmasining elektron spektrida 680 nm da namoyon bo’layotgan
yutilish chizig’i esa, ikki Big→2B
2 g o’tishga to’g’ri keladi va kompleks birikmani
piramida tuzilishiga ega ekanligidan dalolat beradi. Agar 550 nm, 680 nm va 710
nm larda chiziqlar chiqganda edi, unda kompleks birikma 1A
1g →1B
1g , 1A
1g →1A
2g
va 1A
1g →1E
1g o’tishlarga to’g’ri keluvchi yassi kvadratli piramida tuzilishiga ega
deyish mumkin bo’lar edi [19], [20], [21]. Lekin kompleks birikmaning elektron
spektrida faqat bitta 680 nm dagi yutilish chizig’i namoyon bo’ldi. 550 va 710 nm
lardagi nur yutilish chiziqlari kuzatilmadi. Olingan natijalar (IQ-, UB-spektrlariga
asoslanib, kompleks birikmaning tuzilish formulasini quyidagicha ifodalash
mumkin:
Mis(II) tuzlarini elektron spektrlari esa, yuqori oblastda (700, 775, 800 nm
larda) namoyon bo’lishi kuzatildi. Cu(NO
3 )
2 .
3H
2 O tuzi tarkibida uch molekula suv
bo’lganligi uchun Cu(NO
3 )
2 .
3H
2 O ni metanoldagi eritmasini elektron spektri akvo
kompleksini [Cu(H
2 O)
5 ] 2+
chiqish oblastiga (800 nm) yaqin joyda (775 nm),
[Cu(H
2 O)
3 (CH
3 OH)
3 ] 2+
+ ko’rinishida namoyon bo’lyapdi.
Cu(CH
3 COO)
2 .
H
2 O da bitta suv molekulasi bo’lganligi uchun pastki oblastda (700
nm) [Cu(H
2 O) .
(CH
3 OH)
5 ] 2+
ko’rinishida namoyon bo’layotganligi aniqlandi
56](https://docx.uz/documents/6972a677-96ea-44b1-9039-0b5a4a0f2252/page_6.png?v=1)



Xinazolon-4 va uning hosilalarini d-metallar bilan oddiy va aralash ligandli koordinasion birikmalari sintezi